電解液用添加剤及びそれを含む電解液、リチウムイオン二次電池
【課題】電解液の高電位における高い安定性、即ち高い耐酸化性と、高いイオン伝導性及び長期安定性を達成することのできる電解液用添加剤及びそれを含む電解液、リチウムイオン二次電池を提供する。
【解決手段】下記式(1)で表されるホウ素化合物からなる電解液用添加剤。B(X)a(Y)b(Z)c(1)(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。ただし、a=1かつb=2のとき、前記アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。)
【解決手段】下記式(1)で表されるホウ素化合物からなる電解液用添加剤。B(X)a(Y)b(Z)c(1)(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。ただし、a=1かつb=2のとき、前記アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、電気化学デバイスの電解液に用いるのに好適な電解液用添加剤、及び電解液、リチウムイオン二次電池に関する。
【背景技術】
【0002】
近年の電子技術の発展や環境技術への関心の高まりに伴い、様々な電気化学デバイスが用いられている。特に、省エネルギー化への要請が多くあり、それに貢献できるものへの期待はますます高くなっている。そのような電気化学デバイスとしては、例えば、発電デバイスとして太陽電池が挙げられ、蓄電デバイスとして、二次電池、キャパシタ及びコンデンサなどが挙げられる。蓄電デバイスの代表例であるリチウムイオン二次電池は、従来、主として携帯機器用充電地として使用されていたが、近年ではハイブリッド自動車及び電気自動車用電池としての使用が期待されている。
そのような流れの中で、リチウムイオン二次電池にはより一層高いエネルギー密度が求められており、その高いエネルギー密度を達成するため、電池の高電圧化が検討されている。電池の高電圧化には正極の電位を高める必要があり、それに伴い、リチウムイオン二次電池の非水電解液に関しても、高電位における電気化学安定性、即ち耐酸化性を有し、高電圧下でも使用できる電解液が望まれている。
【0003】
上記課題に対して、特許文献1には、電解液の非水溶媒として、フッ素化されたエチレンカーボネート(EC)を用いることにより高電位における安定性の向上を図ることが提案されている。
一方、特許文献2には、ある特定のホウ酸トリアルコキシドを電解液に添加することにより高電位における安定性の向上を図ることが提案されている。また、特許文献3には、ホウ酸トリアルコキシドと非水溶媒とを混合することにより、負極界面での抵抗増大を抑制することなどが提案されている。さらに、特許文献4には、ホウ素の六員環状アルコキシド化合物を非水溶媒に添加することにより、銅−スズ系負極の容量維持率を改善することなどが提案されている。
他方、特許文献5には、トリフェニルボランを電解液に添加することが開示されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開2011−034162号パンフレット
【特許文献2】国際公開2011−037263号パンフレット
【特許文献3】特開2003−132946号公報
【特許文献4】特開2005−222830号公報
【特許文献5】特開平11−003728号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、特許文献1に開示されている非水溶媒のフッ素化は高コストであり、また電解質の溶解性が低下するという問題がある。
また、特許文献1〜4に記載されているように、ホウ酸アルコキシドを電解液に添加する試みはこれまでにも多くなされている。しかしながら、これらのホウ酸アルコキシドは、エステル交換しやすく、非水溶媒中のLiPF6塩と容易にエステル交換し、LiPF6塩を消費して電解液の保存安定性が低下するという課題を有している。
さらに、特許文献5に開示されているトリフェニルボランに代表されるトリアルキルボランは、反応活性が高く、空気中で安定に取り扱うことが難しいといった問題がある。
上述したとおり、リチウムイオン二次電池における高いエネルギー密度を達成するため、電池の高電圧化が検討されており、リチウムイオン二次電池の非水電解液においても、実用に耐え得るイオン伝導性及び長期安定性を満足し、かつ、高電位における安定性、即ち耐酸化性を有する電解液が望まれている。
【0006】
かかる事情に鑑みて、本発明は、電解液の高電位における高い安定性、即ち高い耐酸化性と、高いイオン伝導性及び長期安定性を達成することのできる電解液用添加剤及びそれを含む電解液、リチウムイオン二次電池を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは上記目的を達成すべく鋭意検討した結果、特定の構造を有するホウ素化合物を電解液用添加剤として用いることで、電解液の高電位における安定性と、高いイオン伝導性及び長期安定性を達成することができることを見出し、本発明を完成するに至った。
【0008】
即ち、本発明は下記のとおりである。
[1]
下記式(1)で表されるホウ素化合物からなる電解液用添加剤。
B(X)a(Y)b(Z)c (1)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。ただし、a=1かつb=2のとき、前記アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。)
[2]
前記式(1)で表されるホウ素化合物中のaが1又は2である、上記[1]記載の電解液用添加剤。
[3]
前記式(1)で表されるホウ素化合物中のbが1又は2である、[1]又は[2]記載の電解液用添加剤。
[4]
前記式(1)で表されるホウ素化合物が下記式(2)で表される構造を有する、上記[1]〜[3]のいずれか記載の電解液用添加剤。
B(X)a(Y)b (2)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。a,bはそれぞれ、1又は2の整数を示し、かつ、a+b=3を満たす。)
[5]
前記式(1)で表されるホウ素化合物が下記式(3)で表される構造を有する、上記[1]〜[4]のいずれか記載の電解液用添加剤。
B(X)1(Y)2 (3)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。)
[6]
上記[1]〜[5]のいずれか記載の電解液用添加剤と、非水溶媒と、電解質と、を含有する電解液。
[7]
前記電解液中の前記電解液用添加剤の含有量が、0.5質量%以上50質量%以下である、上記[6]記載の電解液。
[8]
前記電解液の酸化電位が6.3V(vsLi/Li+)以上である、上記[6]又は[7]記載の電解液。
[9]
前期非水溶媒がカーボネート系溶媒である、上記[6]〜[8]のいずれか記載の電解液。
[10]
前記電解質がリチウム塩である、上記[6]〜[9]のいずれか記載の電解液。
[11]
上記[6]〜[9]のいずれか記載の電解液と、
正極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料からなる群より選ばれる1種以上を含有する正極と、
負極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料及び金属リチウムからなる群より選ばれる1種以上を含有する負極と、
を備えるリチウムイオン二次電池。
【発明の効果】
【0009】
本発明により、電解液の高電位における安定性と、高いイオン伝導性及び長期安定性を達成することのできる電解液用添加剤、及びそれを含む電解液、リチウムイオン二次電池を提供することができる。
【図面の簡単な説明】
【0010】
【図1】比較例2における電解液の19F−NMR測定結果を示す図である。
【図2】比較例3における電解液の19F−NMR測定結果を示す図である。
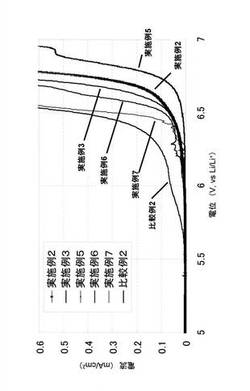
【図3】実施例及び比較例の電解液の耐酸化電位測定により得られたリニアスイープボルタモグラムを示す図である。
【図4】実施例及び比較例の電解液の耐酸化電位測定により得られたリニアスイープボルタモグラムを示す図である。
【図5】実施例及び比較例の電解液の耐酸化電位測定により得られたリニアスイープボルタモグラムを示す図である。
【発明を実施するための形態】
【0011】
以下、本発明を実施するための形態(以下、単に「本実施形態」という。)について詳細に説明する。以下の本実施形態は、本発明を説明するための例示であり、本発明を以下の内容に限定する趣旨ではない。本発明は、その要旨の範囲内で適宜に変形して実施できる。
【0012】
本実施形態における電解液用添加剤は、下記式(1)で表されるホウ素化合物からなる。
B(X)a(Y)b(Z)c (1)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。ただし、a=1かつb=2のとき、前記アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。)
また、本実施形態における電解液は、上記電解液用添加剤と、非水溶媒と、電解質と、を含有する。
さらに、本実施形態におけるリチウムイオン二次電池は、上記電解液と、正極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料からなる群より選ばれる1種以上を含有する正極と、負極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料及び金属リチウムからなる群より選ばれる1種以上を含有する負極と、を備える。
【0013】
<電解液用添加剤>
本実施形態における電解液用添加剤は、下記式(1)で表されるホウ素化合物からなる。
B(X)a(Y)b(Z)c (1)
(式中、置換されていてもよいXは炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。)
【0014】
Xは置換されていてもよい炭素数3〜20の炭化水素基(以下、単に「炭化水素基」ともいう。)を示す。ここで、Xで示される炭化水素基は、ホウ素原子に直接炭素原子が結合している。ホウ素化合物中にホウ素原子に直接結合した炭化水素基が存在することにより、エステル交換、加水分解といった電解液中の副反応を抑制し、ホウ素化合物の安定性が向上するとともに、電解液の高電位における安定性が向上する。Xで示される炭化水素基は、ホウ素化合物中に1つ又は2つ含有することがより好ましい。
【0015】
本実施形態におけるXで示される炭化水素基としては、脂肪族炭化水素基のみならず、フェニル基などの芳香族炭化水素基も含まれる。また、水素原子がすべてフッ素原子に置換されたトリフルオロメチル基などのフッ素置換炭化水素基も含まれる。また、必要に応じて、フッ素原子、塩素原子、臭素原子などのハロゲン原子や、ニトリル基(−CN)、エーテル基(−O−)、カーボネート基(−OCO2−)、エステル基(−CO2−)、カルボニル基(−CO−)スルフィド基(−S−)、スルホキシド基(−SO−)、スルホン基(−SO2−)、ウレタン基(−NHCO2−)といった官能基を導入することができる。
【0016】
Xは、非水溶媒との混和性、イオン伝導性の観点から、炭素数3〜20であり、好ましくは炭素数3〜12であり、より好ましくは炭素数3〜9である。
【0017】
Xの好ましい例としては、n−プロピル基、イソプロピル基、n−ブチル基、s−ブチル基、t−ブチル基などの脂肪族炭化水素基;フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、2−メチルフェニル基、メトキシフェニル基、ニトリル置換フェニル基、フルオロ化フェニル基などの芳香族炭化水素基;ベンジル基などの脂肪族と芳香族が複合された炭化水素基が挙げられる。上記の中でも、イオン伝導性および相溶性の観点から、n−プロピル基、イソプロピル基、n−ブチル基、s−ブチル基、t−ブチル基、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、2−メチルフェニル基、フルオロ化フェニル基がより好ましい。
【0018】
本実施形態におけるホウ素化合物においては、ホウ素原子に結合する置換基が、炭化水素基、アルコキシ基又はカルボキシル基、ハロゲン原子の3種から選ばれる2種以上存在し、これらの置換基が互いに結合して環状構造をとっていても何ら差し支えない。例えば、Xで示される置換されていてもよい炭素数3〜20の炭化水素基は、ホウ素原子と共に下記式(16)で表される環状構造を形成していてもよい。なお、ホウ素化合物が下記式(16)で表される環状構造を有する場合、ホウ素化合物は、2つの炭化水素基を有することとなる。即ち、上記式(1)におけるaが2となり、b又はcが1となる。即ち、ホウ素の残り1つの結合手は、置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基、ハロゲン原子から選ばれる置換基を有することとなる。また、ホウ素化合物が下記式(16)で表される環状構造を有する場合、環状構造全体の炭素数は3〜20となる。例えば、下記式(16)において、Rは炭素数3〜20となる。環状構造の好ましい例としては、ビフェニル構造などが挙げられる。
【0019】
【化1】

【0020】
Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基(以下、単に「アルコキシ基又はカルボキシル基」ともいう。)を示す。アルコキシ基とは、下記式(4)で表される構造であり、この場合、炭素原子が酸素原子を介してホウ素原子に結合する。また、カルボキシル基とは、下記式(5)で表される構造である。本実施形態におけるホウ素化合物は、炭素数1〜20のアルコキシ基又はカルボキシル基を0〜2つの範囲で含む。アルコキシ基は、後述するカルボキシル基と同様に、ホウ素化合物中に存在することで、乾燥空気中におけるホウ素化合物の安定性が向上し、ホウ素化合物の取扱いが容易になる。炭素数1〜20のアルコキシ基又はカルボキシル基は、電解液中でのホウ素化合物の安定性が向上することから、ホウ素化合物中に合計で1つ又は2つ含有することがより好ましい。
【0021】
−OR (4)
−O(C=O)R (5)
【0022】
置換されていてもよい炭素数1〜20のアルコキシ基としては、脂肪族アルコキシ基のみならず、フェノキシ基などの芳香族アルコキシ基も含まれる。また、必要に応じて、フッ素原子、塩素原子、臭素原子などのハロゲン原子や、ニトリル基(−CN)、エーテル基(−O−)、カーボネート基(−OCO2−)、エステル基(−CO2−)、カルボニル基(−CO−)スルフィド基(−S−)、スルホキシド基(−SO−)、スルホン基(−SO2−)、ウレタン基(−NHCO2−)といった官能基を導入することができる。
【0023】
置換されていてもよい炭素数1〜20のアルコキシ基は、非水溶媒との混和性、イオン伝導性の観点から、炭素数1〜20であり、好ましくは炭素数1〜12であり、より好ましくは炭素数2〜9である。
【0024】
置換されていてもよい炭素数1〜20のアルコキシ基の好ましい例としては、メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基、n−ブトキシ基、s−ブトキシ基、t−ブトキシ基などの脂肪族炭化水素系アルコキシ基;トリフルオロエトキシ基、ヘキサフルオロイソプロポキシ基などのフルオロ化アルコキシ基;−OCH2CH2OCH3、−OCH2CH2CH2OCH3、−OCH2CH2OC2H5、−OCH2CH2CH2OC2H5などのエーテル基を含有するアルコキシ基;フェノキシ基、2,6−ジメチルフェノキシ基、2,4,6−トリメチルフェノキシ基、2−メチルフェノキシ基、フルオロ化フェノキシ基などの芳香族系アルコキシ基;−OCH2CH2CN、−OCH2CN、−OCH2CH2CH2CNなどのニトリル基を含有するアルコキシ基;ベンジルアルコキシ基などの脂肪族と芳香族が複合されたアルコキシ基が挙げられる。これらの中でも、イオン伝導性および相溶性の観点から、脂肪族炭化水素系アルコキシ基、エーテル基を含有するアルコキシ基、ニトリル基を含有するアルコキシ基がより好ましく、より高い耐酸化性を達成する観点からニトリル基を含有するアルコキシ基がさらに好ましい。
【0025】
ここで、置換されていてもよい炭素数1〜20のアルコキシ基は、ホウ素原子と共に下記式(6)で表される環状構造を形成していてもよい。この場合、上記式(1)におけるbが2となり、a又はcが1となる。即ち、ホウ素の残り1つの結合手は、置換されていてもよい炭素数3〜20の炭化水素基、ハロゲン原子から選ばれる置換基を有することとなる。また、ホウ素化合物が下記式(6)で表される環状構造を有する場合、環状構造全体の炭素数は1〜20となる。例えば、下記式(6)において、Rは炭素数1〜20となる。なお、上記式(1)のホウ素化合物の置換基のすべてが環状に結合している場合は、ホウ素化合物の全体の炭素数が1〜20となる。
【0026】
【化2】

【0027】
アルコキシ基とホウ素原子とから形成されるジアルコキシド環状構造の好ましい例としては、下記式(7)〜(10)で表される五員環構造が挙げられる。これらの五員環構造は、ホウ素化合物の分子間架橋反応などの副反応が起こりにくく、安定に存在できる傾向にある。なお、本実施形態におけるホウ素化合物には、合成時及び使用時に分子間架橋反応などを生じるおそれがあるため、アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。
【0028】
【化3】

【0029】
本実施形態におけるカルボキシル基は、上記式(5)で表される構造を有する。上述したアルコキシ基と同様、ホウ素化合物中にカルボキシル基が存在することで、乾燥空気中におけるホウ素化合物の安定性が向上し、ホウ素化合物の取扱いが容易になる。
【0030】
置換されていてもよい炭素数1〜20のカルボキシル基としては、脂肪族カルボキシル基のみならず、芳香族カルボキシル基も含まれる。また、必要に応じて、フッ素原子、塩素原子、臭素原子などのハロゲン原子や、ニトリル基(−CN)、エーテル基(−O−)、カーボネート基(−OCO2−)、エステル基(−CO2−)、カルボニル基(−CO−)スルフィド基(−S−)、スルホキシド基(−SO−)、スルホン基(−SO2−)、ウレタン基(−NHCO2−)といった官能基を導入することができる。
【0031】
置換されていてもよい炭素数1〜20のカルボキシル基は、非水溶媒との混和性、イオン伝導性の観点から、炭素数1〜20であり、好ましくは炭素数1〜12であり、より好ましくは炭素数1〜9である。ここで、カルボキシル基の炭素数は、カルボキシル構造(−O−(CO)−)を構成する炭素を含むものである。
【0032】
置換されていてよい炭素数1〜20のカルボキシル基の好ましい例としては、−OCOCH3、−OCOC2H5、−OCOC3H7、−OCOC4H9、−OCOC5H11などの脂肪族炭化水素系カルボキシル基;−OCOCF3、−OCOCH2CF3、−OCOCH(CF3)2などのフルオロ化カルボキシル基;−OCOPh、OCOCH2Phなどの芳香環を含有するカルボキシル基;後述するシュウ酸基などの環状構造を形成するカルボキシル基が挙げられる。上記の中でも、耐酸化性の観点から、−OCOCH3、−OCOC2H5、−OCOC3H7、−OCOC4H9、−OCOC5H11などの脂肪族炭化水素系カルボキシル基、後述するシュウ酸基などの環状構造を形成するカルボキシル基がより好ましい。
【0033】
ここで、置換されていてよい炭素数1〜20のカルボキシル基は、ホウ素原子と共に下記式(11)及び(12)で表される環状構造を形成していてもよい。なお、ホウ素化合物が下記式(11)又は(12)で表される環状構造を有する場合、ホウ素化合物は、2つのカルボキシル基を有することとなる。即ち、上記式(1)におけるbが2となり、a又はcが1となる。即ち、ホウ素の残り1つの結合手は、置換されていてもよい炭素数3〜20の炭化水素基、ハロゲン原子から選ばれる置換基を有することとなる。また、ホウ素化合物が環状構造を有する場合、環状構造全体の炭素数は1〜20となる。例えば、下記式(11)においては、2つのカルボキシル基が2つの炭素を有するため、Rは炭素数1〜18となる。
【0034】
ホウ素化合物が上述した環状構造を有する場合、異なった置換基がホウ素原子と共に環状構成を形成していてもよい。例えば、炭化水素基とカルボキシル基が環状構造を形成していてもよい。
【0035】
【化4】

【0036】
カルボキシル基とホウ素原子とから形成されるジカルボキシル環状構造の好ましい例としては、下記式(13)〜(15)で表される構造が挙げられる。これらの構造は、ホウ素化合物の安定性の観点から好ましい。
【0037】
【化5】

【0038】
Zはハロゲン原子を示す。ハロゲン原子は、フッ素原子、塩素原子、臭素原子、ヨウ素原子から選ばれるが、電解液中での安定性の観点から、フッ素原子、塩素原子が好ましく、フッ素原子がより好ましい。
【0039】
本実施形態における上記式(1)で表されるホウ素化合物は、上記式(1)中のXが置換されていてもよい炭素数3〜20の炭化水素基を示し、Yが置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示し、a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満足する。これは、即ち、アルコキシ基又はカルボキシル基、炭化水素基、ハロゲン原子の3種の中から選ばれる2種以上を含有させることを示しており、これにより電解液の高い高電圧安定性、長期安定性を達成するとともに、LiPF6塩に代表される電解質との副反応を抑制し、その結果、高いイオン伝導性をも達成することができる。
【0040】
なお、上記式(1)中でa=3のとき、ホウ素化合物の置換基がすべて炭化水素基であるBR3となり、b=3のとき、ホウ素化合物の置換基がすべてアルコキシ基又はカルボキシル基であるB(OR)3又はB(OCOR)3となり、c=3のとき、ホウ素化合物の置換基がすべてハロゲン原子であるボラントリハライドとなるが、これらのBR3、B(OR)3、B(OCOR)3、ボラントリハライドは本実施形態のホウ素化合物には含まれない。本実施形態における上記式(1)で表されるホウ素化合物は、アルコキシ基又はカルボキシル基、炭化水素基、ハロゲン原子の3種の中から2種以上を含有させることで、B(OR)3、B(OCOR)3よりも加水分解及びエステル交換が起こりにくく、電解液中でLiPF6塩に代表される電解質との副反応を抑制することができ、かつ、ホウ素化合物のルイス酸性が高いことから、電解液の高電位安定性をより高めることができる。また、本実施形態における上記式(1)で表されるホウ素化合物は、BR3よりも高い酸素安定性及び空気安定性を有することから、空気中での電解液の調製、保管が容易となる。さらに、本実施形態における上記式(1)で表されるホウ素化合物は、ボラントリハライドに比べて電解液中での副反応をより抑制することができる。
【0041】
本実施形態における上記式(1)で表されるホウ素化合物は、aが1又は2であることが好ましい。これは、ホウ素化合物が炭化水素基を1つ又は2つ含有することを示しており、ホウ素化合物中に1つ又は2つの炭化水素基を含有させることにより、電解液中でのLiPF6塩に代表される電解質との副反応を大幅に抑制することができる傾向にあり、かつ、ホウ素化合物のルイス酸性が高まることから、電解液の高電位安定性をより高めることができる傾向にある。
【0042】
本実施形態における上記式(1)で表されるホウ素化合物は、bが1又は2であることが好ましい。これは、ホウ素化合物がアルコキシ基又はカルボキシル基を合計で1つ又は2つ含有することを示しており、ホウ素化合物中に合計で1つ又は2つのアルコキシ基又はカルボキシル基を含有させることにより、ホウ素化合物が高い酸素安定性を有し、乾燥空気中での電解液の調製、保管が容易となる傾向にある。また、ホウ素化合物中に合計で1つ又は2つのアルコキシ基又はカルボキシル基を含有させることにより、電解液の低電位側の安定性、即ち還元安定性が向上する傾向にある。
【0043】
本実施形態における上記式(1)で表されるホウ素化合物は、下記式(2)で表される構造を有することがより好ましい。
B(X)a(Y)b (2)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。a,bはそれぞれ、1又は2の整数を示し、かつ、a+b=3を満たす。)
【0044】
上記式(2)で表される構造は、ホウ素化合物が、少なくとも炭化水素基と、アルコキシ基又はカルボキシル基とを有し、炭化水素基と、アルコキシ基又はカルボキシル基の合計が3となる。このような構造を有することにより、ホウ素化合物がより高い酸素安定性を示すとともに、電解液中でのLiPF6塩に代表される電解質との副反応を大幅に抑制することができ、かつ、ホウ素化合物のルイス酸性が高まることから、電解液の高電位安定性をより高めることができる傾向にある。
【0045】
本実施形態における上記式(1)で表されるホウ素化合物は、下記式(3)で表される構造を有することがさらに好ましい。
B(X)1(Y)2 (3)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は炭素数1〜20のカルボキシル基を示す。)
【0046】
下記式(3)で表される構造は、炭化水素基を1つと、アルコキシ基又はカルボキシル基から選ばれる置換基を2つ含有するホウ素化合物である。
【0047】
上記式(3)で表されるホウ素化合物の中でも特に好ましい構造として、下記式(17)で表される炭化水素基を1つとアルコキシ基を2つ含有するホウ素化合物、下記式(18)で表される炭化水素基を1つとカルボキシル基を2つ含有するホウ素化合物、下記式(19)で表される炭化水素基を1つとアルコキシ基を2つ含有し、2つのアルコキシ基とホウ素原子とから形成される環状構造を有するホウ素化合物、及び、下記式(20)で表されるアルキル基を1つとカルボキシル基を2つ含有し、2つのカルボキシル基とホウ素原子とから形成される環状構造を有するホウ素化合物を挙げることができる。
【0048】
【化6】

【0049】
上記式(17)で表されるホウ素化合物において、R1としては特に限定されないが、非水溶媒との相溶性及び高電位安定性の観点から、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、フルオロフェニル基、−C4H9、−C3H7であることが好ましい。また、R2及びR3としては、それぞれ独立に、−CH3、−C2H5、−C3H7、−C4H9、−C2H4CN、−C2H4OCH3、−CH2CF3、−CH(CF3)2であることが好ましい。
【0050】
上記式(18)で表されるホウ素化合物において、R1としては特に限定されないが、非水溶媒との相溶性及び高電位安定性の観点から、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、フルオロフェニル基、−C4H9、−C3H7であることが好ましい。また、R2及びR3としては、それぞれ独立に、−CH3、−C2H5、−C3H7、−C4H9、−C2H4CN、−C2H4OCH3、−CH2CF3、−CH(CF3)2であることが好ましい。
【0051】
上記式(19)で表されるホウ素化合物において、R1としては特に限定されないが、非水溶媒との相溶性及び高電位安定性の観点から、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、フルオロフェニル基、−C4H9、−C3H7であることが好ましい。また、Rとしては、−CH2CH2−、−CH(CH3)CH(CH3)−、−C(CH3)2C(CH3)2−、−CH=CH−、フェニル基であることが好ましい。
【0052】
上記式(20)で表されるホウ素化合物において、R1としては特に限定されないが、非水溶媒との相溶性及び高電位安定性の観点から、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、フルオロフェニル基、−C4H9、−C3H7であることが好ましい。Rとしては、−CH2−、−CH2CH2−、フェニル基であることが好ましい。また、Rとしては、炭素数0、即ちシュウ酸エステル構造であることも好ましい。
【0053】
本実施形態におけるホウ素化合物の合成方法は特に限定されず、例えば、以下に示すような合成手法を用いて合成することができる。Xで示される炭化水素基の導入に関しては、BH3と不飽和炭化水素基のハイドロボレーション反応、グリニャール試薬を用いた炭化水素基−MgBrとB(OCH3)3を用いたグリニャール反応、を好適に用いることができる。Yで示されるアルコキシ基の導入に関しては、BH3とアルコールの脱水素反応、H3BO3とアルコールを用いた脱水縮合、を好適に用いることができる。Yで示されるカルボキシル基の導入に関しては、H3BO3とカルボン酸を用いた脱水縮合を好適に用いることができる。Zで示されるハロゲン原子の導入に関しては、ボラントリハライドとの交換反応を好適に用いることができる。また、2つの異なるアルコキシ基を導入する方法としては、例えば、R1B(OH)2とHOR4との脱水縮合によりR1B(O−R4)2の構造を有する化合物を合成し、R1B(OH)2とHOR5との脱水縮合によりR1B(O−R5)2の構造を有する化合物を合成した後に、得られたこれらのR1B(O−R4)2の構造を有する化合物とR1B(O−R5)2の構造を有する化合物を等mol混合し、室温で攪拌してエステル交換反応をさせることにより、R1B(O−R4)(O−R5)の構造を有する化合物を得ることができる。
【0054】
<電解液>
本実施形態における電解液は、上記式(1)で表されるホウ素化合物と、非水溶媒と、電解質と、を含有する。本実施形態における電解液は、リチウムイオン二次電池、リチウムイオンキャパシタに代表される蓄電デバイスの電解液として好適に用いることができる。
【0055】
非水溶媒としては、様々なものを用いることができるが、リチウムイオン二次電池及びリチウムイオンキャパシタなどの電解液に用いられる場合、非プロトン性極性溶媒が好ましい。その具体例としては、エチレンカーボネート、プロピレンカーボネート、1,2−ブチレンカーボネート、トランス−2,3−ブチレンカーボネート、シスー2,3−ブチレンカーボネート、1,2−ペンチレンカーボネート、トランス−2,3−ペンチレンカーボネート、シスー2,3−ペンチレンカーボネート、トリフルオロメチルエチレンカーボネート、フルオロエチレンカーボネート及び4,5−ジフルオロエチレンカーボネートになどの環状カーボネート;γープチロラクトン及びγーバレロラクトンなどのラクトン;スルホランなどの環状スルホン;テトラヒドロフラン及びジオキサンなどの環状エーテル;メチルエチルカーボネート、ジメチルカーボネート、ジエチルカーボネート、メチルプロピルカーボネート、メチルイソプロビルカーボネート、ジプロピルカーボネート、メチルブチルカーボネート、ジブチルカーボネート、エチルプロピルカーボネート及びメチルトリフルオロエチルカーボネートなどの鎖状カーボネート;アセトニトリルなどのニトリル;ジメチルエーテルなどの鎖状エ一テル;プロピオン酸メチルなどの鎖状カルボン酸エステル;ジメトキシエタンなどの鎖状エーテルカーボネート化合物が挙げられる。これらは1種を単独で又は2種以上を組み合わせて用いることができる。
【0056】
非水溶媒としては、イオン伝導性の観点から、環状カーボネート、鎖状カーボネートなどのカーボネート系溶媒を用いることがより好ましい。また、カーボネート系溶媒として、環状カーボネートと鎖状カーボネートを組合せて用いることがさらに好ましい。環状カーボネートとしては様々なものを用いることができるが、エチレンカーボネート、プロピレンカーボネート、フルオロエチレンカーボネートが好ましく、エチレンカーボネート、プロピレンカーボネートがより好ましい。鎖状カーボネートとしては様々なものを用いることができるが、メチルエチルカーボネート、ジメチルカーボネート、ジエチルカーボネートが好ましい。
【0057】
カーボネート系溶媒として、環状カーボネートと鎖状カーボネートを組合せて含む場合、環状カーボネートと鎖状カーボネートとの混合比は、イオン伝導性の観点から、体積比で1:10〜5:1であることが好ましく、1:5〜3:1であることがより好ましい。
【0058】
カーボネート系溶媒を用いる場合、電池物性改善の観点から、必要に応じて、アセトニトリル、スルホラン等の別の非水溶媒をさらに添加することができる。
【0059】
特に、電解液がリチウムイオン二次電池及びリチウムイオンキャパシタに使用される場合、その充放電に寄与する電解質であるリチウム塩の電離度を高めるために、非水溶媒は、環状の非プロトン性極性溶媒を1種以上含むことが好ましい。同様の観点から、非水溶媒は、エチレンカーボネート及びプロピレンカーボネートなどの環状カーボネートを1種以上含むことがより好ましい。環状の化合物は誘電率が高く、リチウム塩の電離を助けることによりイオン伝導性の向上に寄与することができる。
【0060】
電解質は、電解液において、通常の非水電解質として用いられているものであれば特に限定されない。電解液がリチウムイオン二次電池及びリチウムイオンキャパシタに用いられる場合、電解質としてはリチウム塩を使用することが好ましい。リチウム塩としては、例えば、LiPF6、LiBF4、LiCIO4、LiAsF6、Li2SiF6、LiOSO2CkF2k+1〔kは1〜8の整数〕、LiN(SO2CkF2k+1)2〔kは1〜8の整数〕、LiPFn(CkF2k+1)6-n[nは1〜5の整数、kは1〜8の整数〕、LiBFn((CkF2k+1)4-n[nは1〜3の整数、kは1〜8の整数〕、LiB(C204)2で表されるリチウムビスオキサリルボレート、LiBF2(C204)で表されるリチウムジフルオロオキサリルボレート、LiPF4(C202)で表されるリチウムトリフルオロオキサリルフォスフエートが挙げられる。
【0061】
これらの電解質は、1種を単独で又は2種以上を組み合わせて用いることができる。リチウムイオン二次電池及びリチウムイオンキャパシタの用途では、これらの電解質の中でも、イオン伝導性や安定性の観点から、LiPF6、LiBF4、LiN(SO2CkF2k+1)2〔kは1〜8の整数〕、及びLiB(C2O4)2が好ましく、LiPF6、及びLiBF4がより好ましい。
【0062】
電解質の濃度は特に限定されないが、イオン伝導性の観点から、電解液に対して0.1〜3mol/kgであることが好ましく、より好ましくは0.3〜2.5mol/kg、さらに好ましくは、0.5〜2mol/kg、特に好ましくは0.5〜1.5mol/kgである。
【0063】
本実施形態における式(1)で表される電解液用添加剤の電解液中の含有量は特に制限されないが、好ましくは、0.5質量%以上50質量%以下である。電解液用添加剤の含有量を0.5質量%以上とすることで、電解液に良好な高電位における安定性を付与することができる傾向にあり、50質量%以下とすることで、良好なイオン伝導性を付与することができる傾向にある。より好ましくは1質量%以上40質量%以下、さらに好ましくは2質量%以上35質量%以下、特に好ましくは3質量%以上30質量%以下である。
【0064】
本実施形態における式(1)で表されるホウ素化合物は、必要に応じて1種又は2種以上混合して用いてもよい。2種以上混合して用いる場合の含有量は特に制限されないが、2種以上のホウ素化合物の含有量の合計が上記含有量の範囲を満たすことが好ましい。
【0065】
本実施形態における電解液は、酸化電位が6.3V(vsLi/Li+)以上であることが好ましい。電解液の酸化電位を6.3V(vsLi/Li+)以上とすることで高電位における高い安定性が確保され、電池に高電位の正極を用いても、電解液が大きく劣化することなく、高電位化した電池のより高い安定性に寄与できる傾向にある。電解液の酸化電位は、6.35V(vsLi/Li+)以上であることがより好ましく、6.4V(vsLi/Li+)以上であることがさらに好ましい。ここで、酸化電位の測定手法としては、作用極に白金極、対極及び参照極に金属Li極を用いた三極セルに電解液を注入して測定セルを作製し、ポテンシオガルバノスタットを用いて測定セルのリニアスイープボルタンメトリー(以下、「LSV」ともいう。)を行うことにより測定することができる。LSV測定で自然電位から7.5V(vsLi/Li+)まで0.1mV/secで掃引し、電流値が0.1mA/cm2となる電位を電解液の酸化電位とする。この酸化電位が高電位安定性の指標となる。
【0066】
本実施形態における電解液には、必要に応じて、本実施形態のホウ素化合物以外の添加剤を含有させることができる。電池のサイクル特性を向上させる観点からは、ビニレンカーボネート、フルオロエチレンカーボネート、エチレンスルファイトなどを添加剤として含有させることが好ましい。
【0067】
<リチウムイオン二次電池>
本実施形態における電解液は、リチウムイオン二次電池の電解液として好適に用いることができる。本実施形態におけるリチウムイオン二次電池は、上述した電解液と、正極、負極と、必要に応じてセパレータを備える。
【0068】
正極は、リチウムイオン二次電池の正極として作用するものであれば特に限定されず、公知のものを用いることができる。正極は、正極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料からなる群より選ばれる1種以上を含有することが好ましい。そのような材料としては、例えば、LixMO2(ここで、Mは遷移金属から選ばれる1種以上の金属を示し、Xは0〜1の数を示す。)及びLiyM2O4(ここで、Mは遷移金属から選ばれる1種以上の金属を示し、yは0〜2の数を示す。)で表される複合酸化物、トンネル構造及び層状構造を有する金属カルコゲン化物及び金属酸化物、オリビン型リン酸化合物が挙げられる。
【0069】
リチウムイオンを吸蔵及び放出することが可能な材料としては、より具体的には、例えば、LiCoO2などのリチウムコバルト酸化物;LiMnO2、LiMn2O4、Li2Mn2O4などのリチウムマンガン酸化物;LiNiO2などのリチウムニッケル酸化物;LiNi0.33Mn0.33Co0.33O2などのLizMO2(ここで、MはNi、Mn、Co、AI及びMgからなる群より選ばれる2種以上の元素を示し、zは0.9超1.2未満の数を示す。)で表されるリチウム含有複合金属酸化物;LiFePO4で表されるリン酸鉄オリビン;LiNi0.5Mn1.5O4などの高電圧対応正極;Li2M’O3−LiMO2(ここで、M’及びMは遷移金属から選ばれる1種以上の金属を示す。)などの固溶体正極が挙げられる。また、正極活物質として、例えば、S、MnO2、Fe02、FeS2、V205、V6013、TiO2、TiS2、MoS2及びNbSe2などのリチウム以外の金属の酸化物を含んでいてもよい。さらには、ポリアニリン、ポリチオフエン、ポリアセチレン及びポリピロールなどの導電性高分子も正極活物質として含んでいてもよい。
【0070】
また、正極活物質としてリチウム含有化合物を用いると、高電圧及び高エネルギー密度を得ることができる傾向にあるため好ましい。このようなリチウム含有化合物としては、リチウムを含有するものであればよく、例えば、リチウムと遷移金属元素とを含む複合酸化物、リチウムと遷移金属元素とを含むリン酸化合物、及びリチウムと遷移金属元素とを含むLitMuSiO4(ここで、Mは遷移金属から選ばれる1種以上の金属、tは0〜1の数、uは0〜2の数を示す。)などのケイ酸金属化合物が挙げられる。より高い電圧を得る観点から、特に、リチウムと、コバルト(Co)、ニッケル(Ni)、マンガン(Mn)、鉄(Fe)、(Cu)、亜鉛(Zn)、クロム(Cr)、バナジウム(V)及びチタン(Ti)からなる群より選ばれる1種以上の遷移金属元素とを含む複合酸化物やリン酸化合物が好ましい。
【0071】
リチウム含有化合物としては、リチウムを有する金属酸化物、リチウムを有する金属カルコゲン化物及びリチウムを有するリン酸金属化合物が好ましく、例えば、下記式(21a)及び(21b)で表される化合物が挙げられる。
LiMO2 (21a)
LiMPO4 (21b)
ここで、式中、Mは1種以上の遷移金属元素を示す。
【0072】
上記式(21a)で表される化合物は一般に層状構造を有し、上記一般式(21b)で表される化合物は一般にオリビン構造を有する。これらの化合物は、構造を安定化させる等の目的から、遷移金属元素の一部をAI、Mg、その他の遷移金属元素で置換したり結晶粒界に含ませたりしたもの、酸素原子の一部をフッ素原子等で置換したものであってもよい。更に、正極活物質表面の少なくとも一部に他の正極活物質を被覆したものも挙げられる。
【0073】
正極活物質は、1種を単独で又は2種以上を組み合わせて用いることができる。正極活物質の数平均粒子径(一次粒子径)は、好ましくは0.05μm〜100μm、より好ましくは1μm〜10μmである。正極活物質の数平均粒子径は、湿式の粒子径測定装置(例えば、レーザー回折/散乱式粒度分布計、動的光散乱式粒度分布計)により測定することができる。あるいは、透過型電子顕微鏡にて観察した粒子100個をランダムに抽出し、画像解析ソフト(例えば、旭化成エンジニアリング株式会社製の画像解析ソフト、商品名「A像くん」)で解析し、その相加平均を算出することでも得られる。この場合、同じ試料に対して、測定方法間で数平均粒子径が異なる場合は、標準試料を対象として作成した検量線を用いてもよい。
【0074】
正極は、例えば、下記のようにして得られる。まず、上記正極活物質に対して、必要に応じて、導電助剤やバインダー等を加えて混合した正極合剤を溶剤に分散させて正極合剤含有ペーストを調製する。次いで、この正極合剤含有ペーストを正極集電体に塗布し、乾燥して正極合剤層を形成し、それを必要に応じて加圧し厚みを調整することによって、正極が作製される。ここで、正極合剤含有ペースト中の固形分濃度は、好ましくは30〜80質量%であり、より好ましくは40〜70質量%である。正極集電体は、例えば、アルミニウム箔、又はステンレス箔などの金属箔により構成される。
【0075】
負極は、リチウムイオン二次電池の負極として作用するものであれば特に限定されず、公知のものを用いることができる。負極は、負極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料及び金属リチウムからなる群より選ばれる1種以上を含有することが好ましい。即ち、負極は、負極活物質として、金属リチウム、炭素材料、リチウムと合金形成が可能な元素を含む材料、及び、リチウム含有化合物からなる群より選ばれる1種以上の材料を含有することが好ましい。炭素材料としては、例えば、ハードカーボン、ソフトカーボン、人造黒鉛、天然黒鉛、黒鉛、熱分解炭素、コークス、ガラス状炭素、有機高分子化合物の焼成体、メソカーボンマイクロビーズ、炭素繊維、活性炭、グラファイト、炭素コロイド、カーボンブラックが挙げられる。コークスとしては、例えば、ピッチコークス、二一ドルコークス及び石油コークスが挙げられる。また、有機高分子化合物の焼成体とは、フェノール樹脂やフラン樹脂などの高分子材料を適当な温度で焼成して炭素化したものである。
【0076】
さらに、リチウムイオンを吸蔵及び放出することが可能な材料としては、リチウムと合金を形成可能な元素を含む材料も挙げられる。この材料は金属又は半金属の単体であっても、合金や化合物であってもよく、またこれらの1種又は2種以上の相を少なくとも一部に有するようなものであってもよい。なお、本明細書において、「合金」には、2種以上の金属元素からなるものに加えて、1種以上の金属元素と1種以上の半金属元素とを有するものも含まれる。また、合金には、全体として金属の性質を有するものであれば非金属元素が含まれていてもよい。
【0077】
金属元素及び半金属元素としては、例えば、チタン(Ti)、スズ(Sn)、鉛(Pb)、アルミニウム、インジウム(In)、ケイ素(Si)、亜鉛(Zn)、アンチモン(Sb)、ビスマス(Bi)、ガリウム(Ga)、ゲルマニウム(Ge)、ヒ素(As)、銀(Ag)、ハフニウム(Hf)、ジルコニウム(Zr)及びイットリウム(Y)が挙げられる。
【0078】
これらの中でも、長周期型周期表における4族又は14族の金属元素及び半金属元素が好ましく、特に好ましくはチタン、ケイ素及びスズである。
【0079】
スズの合金としては、例えば、スズ以外の第2の構成元素として、ケイ素、マグネシウム(Mg)、ニッケル、銅、鉄、コバルト、マンガン、亜鉛、インジウム、銀、チタン(Ti)、ゲルマニウム、ビスマス、アンチモン及びクロム(Cr)からなる群より選ばれる1種以上の元素を有するものが挙げられる。
【0080】
ケイ素の合金としては、例えば、ケイ素以外の第2の構成元素として、スズ、マグネシウム、ニッケル、銅、鉄、コバルト、マンガン、亜鉛、インジウム、銀、チタン、ゲルマニウム、ビスマス、アンチモン及びクロムからなる群より選ばれる1種以上の元素を有するものが挙げられる。
【0081】
チタン化合物、スズ化合物及びケイ素化合物としては、例えば、酸素(O)又は炭素(C)を有するものが挙げられ、チタン、スズ又はケイ素に加えて、上述の第2の構成元素を有していてもよい。
【0082】
また、リチウムイオンを吸蔵及び放出することが可能な材料としては、リチウム含有化合物も挙げられる。リチウム含有化合物としては、正極材料として例示したものと同様のものが挙げられる。
【0083】
負極活物質は1種を単独で又は2種以上を組み合わせて用いることができる。負極活物質の数平均粒子径(一次粒子径)は、好ましくは0.1μm〜100μm、より好ましくは1μm〜10μmである。負極活物質の数平均粒子径は、正極活物質の数平均粒子径と同様にして測定される。
【0084】
負極は、例えば、下記のようにして得られる。即ち、まず、上記負極活物質に対して、必要に応じて、導電助剤やバインダー等を加えて混合した負極合剤を溶剤に分散させて負極合剤含有ペーストを調製する。次いで、この負極合剤含有ペーストを負極集電体に塗布し、乾燥して負極合剤層を形成し、それを必要に応じて加圧し厚みを調整することによって、負極が作製される。ここで、負極合剤含有ペースト中の固形分濃度は、好ましくは30〜80質量%であり、より好ましくは40〜70質量%である。負極集電体は、例えば、銅箔、ニッケル箔又はステンレス箔などの金属箔により構成される。
【0085】
正極及び負極の作製において、必要に応じて用いられる導電助剤としては、例えば、グラファイト、アセチレンブラック及びケッチェンブラックなどのカーボンブラックや、炭素繊維が挙げられる。導電助剤の数平均粒子径(一次粒子径)は、好ましくは0.1μm〜100μm、より好ましくは1μm〜10μmであり、正極活物質の数平均粒子径と同様にして測定される。また、バインダーとしては、例えば、ポリフッ化ビニリデン(PVDF)、ポリテトラフルオロエチレン(PTFE)、ポリアクリル酸、スチレンブタジエンゴム及びフッ素ゴムが挙げられる。
【0086】
本実施形態におけるリチウムイオン二次電池は、正負極の短絡防止、シャットダウン等の安全性付与の観点から、正極と負極との間にセパレータを備えることが好ましい。セパレータとしては、公知のリチウムイオン二次電池に備えられるものと同様のものを用いることができ、中でも、イオン透過性が大きく、機械的強度に優れる絶縁性の薄膜が好ましい。セパレータとしては、例えば、織布、不織布、合成樹脂製微多孔膜が挙げられ、これらの中でも、合成樹脂製微多孔膜が好ましい。合成樹脂製微多孔膜としては、例えば、ポリエチレン又はポリプロピレンを主成分として含有する微多孔膜、又はこれらのポリオレフィンを共に含有する微多孔膜等のポリオレフィン系微多孔膜が好適に用いられる。不織布としては、セラミック製、ポリオレフィン製、ポリエステル製、ポリアミド製、液晶ポリエステル製、アラミド製などの耐熱樹脂製の多孔膜が用いられる。セパレータは、1種の微多孔膜を単層又は複数積層したものであってもよく、2種以上の微多孔膜を積層したものであってもよい。
【0087】
本実施形態におけるリチウムイオン二次電池は、例えば、セパレータと、そのセパレータを両側から挟む正極と負極と、さらにそれらの積層体を挟む正極集電体(正極の外側に配置)と、負極集電体(負極の外側に配置)と、それらを収容する電池外装とを備える。正極とセパレータと負極とを積層した積層体は、本実施形態における電解液に含浸されている。これらの各部材としては、電解液を除いて、従来のリチウムイオン二次電池に備えられるものと同様のものを用いることができ、例えば上述したものを用いることができる。
【0088】
本実施形態におけるリチウムイオン二次電池は、上述の電解液、正極、負極及び必要に応じてセパレータを用いて、公知の方法により作製することができる。例えば、正極と負極とを、その間にセパレータを介在させた積層状態で巻回して巻回構造の積層体に成形したり、それらを折り曲げや複数層の積層などによって、交互に積層した複数の正極と負極との間にセパレータが介在する積層体に成形し、次いで、電池ケース(外装)内にその積層体を収容して、電解液をケース内部に注液し、上記積層体を電解液に浸漬して封印することによって、リチウムイオン二次電池を作製することができる。本実施形態におけるリチウムイオン二次電池の形状は、特に限定されず、例えば、円筒形、楕円形、角筒型、ボタン形、コイン形、扁平形及びラミネート形などが好適に採用される。
【0089】
本実施形態における電解液は、高電位における高い安定性、即ち高い耐酸化性と、高いイオン伝導性及び長期安定性を実現する。また、本実施形態におけるリチウムイオン二次電池は、高電位での充放電において高い安定性及び高い出力性能を有する。具体的には、電解液に上記式(1)で表される特定のホウ素化合物を含有させることにより、高いイオン伝導性を保持しつつ、高電位における安定性を大幅に向上させることができる。また、上記式(1)で表される特定のホウ素化合物を用いた場合、電解液の安定性を損なうような副反応も回避することができ電解液の長期安定性を担保することができる。さらに、リチウムイオン二次電池に上記式(1)で表される特定のホウ素化合物を含有させた電解液を用いることで、高い出力性能を保持しつつ、高電位での充放電において高い安定性を達成することができる。
【実施例】
【0090】
以下、実施例によって本発明を更に詳細に説明するが、本発明はこれらの実施例に限定されるものではない。なお、電解液用添加剤、電解液及びリチウムイオン二次電池の各種特性及び安全性は下記のとおりに測定及び評価した。
【0091】
(1)電解液のイオン伝導度測定
サンプル瓶で各成分を混合して電解液を調製した。東亜DKK(株)製の電気伝導度計「CM−21P」(商品名)に繋いだ東亜DKK(株)製の電気伝導度測定用セル「CT−57101B」(商品名)を電解液の入ったサンプル瓶に挿入し、25℃での電解液のイオン伝導度を測定した。
【0092】
(2)電解液の酸化電位測定
作用極に白金極、対極及び参照極に金属Li極を用いた三極セル(作用極及び対極の有効面積は2cm2)にポリオレフィン製セパレータを投入し、電解液を1mL注入し測定セルを作製した。ソーラトロン社製の電気化学測定装置(商品名1255B)に測定セルを接続し、自然電位から7.5V(vsLi/Li+)まで高電位側へ0.1mV/secの掃引速度でリニアスイープボルタンメトリー測定を行った。高電位側への掃引において電解液の電流値が0.1mA/cm2となる電位を電解液の酸化電位とした。
【0093】
(3)電解液中での副反応の有無の確認
各成分を混合して電解液を調製後、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液の1H−NMR、19F−NMRを測定し、電解液中で混合した各成分の副反応の有無を確認した。
【0094】
(4)電解液の保存安定性評価
各成分を混合して電解液を調製後、乾燥アルゴン雰囲気下、25℃で20日静置した電解液の変色の有無、沈殿の有無を目視で確認した。
【0095】
(5)リチウムイオン二次電池の放電容量測定
正極活物質としてLiNi0.33Mn0.33Co0.33O2(日本化学工業社製、セルシードNMC)と、導電助剤としてグラファイトとアセチレンブラックの混合粉末と、バインダーとしてポリフッ化ビニリデン溶液(クレハ社製、L#1320)とを固形分比で100:6:4.6の質量比で混合した。得られた混合物に分散溶媒としてN−メチル−2−ピロリドンを固形分66質量%となるように投入して更に混合して、スラリー状の溶液を調製した。このスラリー状の溶液を厚さ20μmのアルミニウム箔の片面に塗布し、溶剤を乾燥除去した後、ロールプレスで圧延した。圧延後のものを直径16mmの円盤状に打ち抜いて正極を得た。
負極活物質としてグラファイト粉末(大阪ガスケミカル社製、OMAC1.2H/SS)及びグラファイト粉末(TIMCAL社製、SFG6)、バインダーとしてスチレンブタジエンゴム(SBR)及びカルボキシメチルセルロース水溶液を用い、上記の順に90:10:1.5:1.8の固形分質量比で混合し、分散媒に水を用いて固形分濃度45質量%となるスラリー状の溶液を調製した。このスラリー状の溶液を厚さ18μmの銅箔の片面に塗布し、溶剤を乾燥除去した後、ロールプレスで圧延した。圧延後のものを直径16mmの円盤状に打ち抜いて負極を得た。
上述のようにして作製した正極と負極とをポリエチレンからなるセパレータ(膜厚25μm、空孔率50%、孔径0.1μm〜1μm)の両側に重ね合わせた積層体を、SUS製の円盤型電池ケースに挿入した。次いで、その電池ケース内に実施例及び比較例で作製した電解液を0.5mL注入し、積層体を電解液に浸漬した後、電池ケースを密閉してリチウムイオン二次電池を作製した。
得られたリチウムイオン二次電池の放電容量測定は、アスカ電子(株)製、充放電装置ACD−01(商品名)及び二葉科学社製、恒温槽PLM−73S(商品名)を用いて行った。1mAの定電流で充電し、4.2Vに到達した後、4.2Vの定電圧で、合計8時間充電を行った。その後、1mAの定電流で3.0Vまで放電したときの放電容量を測定した。このときの電池周囲温度は25℃に設定した。
【0096】
(6)リチウムイオン二次電池のサイクル試験後の放電容量測定
容量維持率の測定は、アスカ電子(株)製、充放電装置ACD−01(商品名)及び二葉科学社製、恒温槽PLM−73S(商品名)を用いて行った。測定用のリチウムイオン二次電池として、上記(5)リチウムイオン二次電池の放電容量測定で作製し、放電容量の測定を行った電池を用いた。充放電サイクル試験では、まず、3mAの定電流で充電し、4.2Vに到達した後、4.2Vの定電圧で、合計3時間充電を行った。その後、3mAの定電流で放電し、3.0Vに到達した時点で再び、充電を繰り返した。充電と放電とを各々1回ずつ行うのを1サイクルとし、10サイクルの充放電を行い、10サイクル目の放電容量を測定した。電池の周囲温度は25℃に設定した。
【0097】
[実施例1]
乾燥窒素雰囲気のフラスコ中で、n−ブチルボロン酸(化学式:CH3CH2CH2CH2B(OH)2、和光純薬製)を10.0gと、エチレンシアノヒドリン(化学式:HOCH2CH2CN、東京化成社製)を17.4gとを混合し、共沸溶媒としてトルエンを30g混合し、オイルバス設定140℃で6時間加熱し脱水縮合を行った。その後、減圧下でトルエンを除去後、120℃、0.5mmHgにて減圧蒸留にて精製を行い、下記式(22)で表されるホウ素化合物Aを得た。ホウ素化合物Aの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物A]1H-NMR(CDCl3) 0.81 (2H,m), 0.90 (3H,m), 1.35 (4H,m), 2.63 (4H,t,J=6.3Hz), 4.07 (4H,t,6.3Hz) pp
CH3CH2CH2CH2−B(OCH2CH2CN)2 (22)
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒(キシダ化学(株)製、LBG−00883)6.67gと、ホウ素化合物A3.33gとを混合し、得られた混合液に、LiBF4(キシダ化学(株)製)1.03gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.50Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0098】
[実施例2]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、実施例1で合成したホウ素化合物Aを3.33gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)1.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.72Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0099】
[実施例3]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を9.00gと、実施例1で合成したホウ素化合物Aを1.00gとを混合し、得られた混合液に、LiPF61.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.55Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
得られた電解液を用いてリチウムイオン二次電池を作製し、リチウムイオン二次電池の放電容量測定を行ったところ、放電容量は3.1mAhであった。また、リチウムイオン二次電池の容量維持率測定(サイクル試験)を行ったところ、10サイクル目の放電容量は、2.6mAhであった。
【0100】
[実施例4]
乾燥窒素雰囲気のフラスコ中で、2,4,6−トリメチルフェニルボロン酸(和光純薬製)を20.0gと、エチレンシアノヒドリンを22.3gとを混合し、共沸溶媒としてトルエンを40g混合し、オイルバス設定140℃で6時間加熱し脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、下記式(23)で表されるホウ素化合物Bを合成した。ホウ素化合物Bの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物B]1H-NMR(CDCl3) 2.27 (3H,s), 2.30 (6H,s), 2.64 (4H,t,J=6.3Hz), 4.08 (4H,t,J=6.3Hz),6.83 (2H,s) ppm
【0101】
【化7】

【0102】
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒6.67gと、上記式(23)で表されるホウ素化合物Bを3.33gとを混合し、得られた混合液に、LiBF4を1.03g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.46Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、1.1mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0103】
[実施例5]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒6.67gと、実施例4で合成したホウ素化合物Bを3.33gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)1.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.73Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、2.5mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0104】
[実施例6]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒9.00gと、実施例4で合成したホウ素化合物Bを1.00gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)1.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.51Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、6.8mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
得られた電解液を用いてリチウムイオン二次電池を作製し、リチウムイオン二次電池の放電容量測定を行ったところ、放電容量は3.3mAhであった。また、リチウムイオン二次電池の容量維持率測定(サイクル試験)を行ったところ、10サイクル目の放電容量は、3.0mAhであった。
【0105】
[実施例7]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒9.50gと、実施例4で合成したホウ素化合物Bを0.50gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)1.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.45Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、8.0mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0106】
[実施例8]
乾燥窒素雰囲気のフラスコ中で、フェニルボロン酸(化学式:Ph−B(OH)2、和光純薬製)を25.0gと、エチレンシアノヒドリンを36.3gとを混合し、共沸溶媒としてトルエンを40g混合し、オイルバス設定140℃で6時間加熱し脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、下記式(24)で表されるホウ素化合物Cを合成した。ホウ素化合物Cの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物C]1H-NMR(CDCl3) 2.70 (4H,t,J=6.1Hz), 4.31 (4H,t,J=6.1Hz), 7.78-7.79 (5H,m) ppm
【0107】
【化8】

【0108】
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒8.00gと、ホウ素化合物C2.00gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)を1.79g添加して溶解させることによいり電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.64Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0109】
[実施例9]
乾燥窒素雰囲気のフラスコ中で、2,3,4,5,6−ペンタフルオロフェニルボロン酸(アルドリッチ社製)を10.0gと、エチレンシアノヒドリンを6.7gとを混合し、共沸溶媒としてトルエンを40g混合し、オイルバス設定140℃で6時間加熱して脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、下記式(25)で表されるホウ素化合物Dを合成した。ホウ素化合物Dの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物D]1H-NMR(CDCl3) 2.65 (4H,t,J=6.1Hz), 4.17 (4H,t,J=6.1Hz) ppm
【0110】
【化9】

【0111】
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒8.00gと、ホウ素化合物Dを2.00gとを混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.42Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、3.1mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0112】
[実施例10]
乾燥窒素雰囲気のフラスコ中で、2,4,6−トリフルオロフェニルボロン酸(アルドリッチ社製)を5.0gと、エチレンシアノヒドリンを4.1gとを混合し、共沸溶媒としてトルエンを30g混合し、オイルバス設定140℃で6時間加熱して脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、下記式(26)で表されるホウ素化合物Eを合成した。ホウ素化合物Eの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物E]1H-NMR(CDCl3) 2.68 (4H,t,J=6.1Hz), 4.18 (4H,t,J=6.1Hz), 6.65 (2H,s) ppm
【0113】
【化10】

【0114】
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒9.00gと、ホウ素化合物E1.00gとを混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.52Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0115】
[比較例1]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒10.00gに、LiBF4を1.03g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.22Vであった。また、イオン伝導度を測定したところ、3.7mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0116】
[比較例2]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒10.00gに、LiPF6(キシダ化学(株)製)を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.29Vであった。また、イオン伝導度を測定したところ、9.4mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
得られた電解液を用いてリチウムイオン二次電池を作製し、リチウムイオン二次電池の放電容量測定を行ったところ、放電容量は3.3mAhであった。また、リチウムイオン二次電池の容量維持率測定(サイクル試験)を行ったところ、10サイクル目の放電容量は、3.1mAhであった。
【0117】
[比較例3]
乾燥窒素雰囲気のフラスコ中で、ホウ酸(和光純薬製)を6.2gと、エチレンシアノヒドリンを25.0gとを混合し、共沸溶媒としてトルエンを35g混合し、オイルバス設定140℃で6時間加熱して脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、B(OCH2CH2CN)3の構造を有するホウ素化合物Fを合成した。ホウ素化合物Fの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物F]1H-NMR(CDCl3) 2.64 (6H,t,J=6.3Hz), 4.07 (6H,t,J=6.3Hz) ppm
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、合成したホウ素化合物Fを3.33g混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.62Vであった。また、イオン伝導度を測定したところ、2.8mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した後、該電解液のF−NMR測定を行ったところ、LiPF6の含有量が低減し、副反応により生成したと考えられるピークが多数生成していることがわかった。該電解液の19F−NMRを図2に、比較例2で得られた電解液の19F−NMRを図1に示す。図1のF−NMRにおいて、LiPF6に由来するピークが−73ppm及び−75ppmに確認される。これに対し、図2のF−NMRにおいては、−80ppmから−90ppm、及び−130ppmから−160ppmに、LiPF6との副反応により生成したと考えられるピークが多数生成していることがわかる。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、褐色に変色していることが確認された。アルコキシ基を3つ有するホウ酸エステルとLiPF6塩が反応し、電解液の安定性が低下したことがわかる。
【0118】
[比較例4]
乾燥窒素雰囲気のフラスコ中で、比較例3で合成したホウ素化合物Fを15.0gと、B(Oi−Pr)3(東京化成社製)を6.4g混合し、40℃で6時間加熱することで、B(Oi−Pr)(OCH2H2CN)2の構造を有するホウ素化合物Gを合成した。
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、ホウ素化合物Gを3.33gとを混合し、得られた混合液に、LiBF41.03gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.14Vであった。また、イオン伝導度を測定したところ、1.6mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0119】
[比較例5]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、比較例4で合成したホウ素化合物Gを3.33gとを混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.60Vであった。また、イオン伝導度を測定したところ、2.8mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置したところ、電解液が褐色に変色していた。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、褐色に変色し、沈殿が生じていることが確認された。アルコキシ基を3つ有するホウ酸エステルとLiPF6塩が反応し、電解液の安定性が低下したことがわかる。
得られた電解液を用いてリチウムイオン二次電池を作製し、リチウムイオン二次電池の放電容量測定を行ったところ、放電容量は1.7mAhであった。また、リチウムイオン二次電池の容量維持率測定(サイクル試験)を行ったところ、10サイクル目の放電容量は、0.6mAhであった。
【0120】
[比較例6]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、下記式(27)で表されるメトキシピナコールボラン(アルドリッチ社製、以下、「ホウ素化合物H」という。)を3.33gとを混合し、得られた混合液に、LiBF4(キシダ化学(株)製)を1.03g添加して溶解させることにより電解液を作製した。
【0121】
【化11】

【0122】
得られた電解液の酸化電位測定を行ったところ、5.51Vであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0123】
[比較例7]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、ホウ素化合物Hを3.33gとを混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製したところ、LiPF6を溶解させた後、30分後には白色の沈殿が析出し、均一な電解液が得られなかった。アルコキシ基を3つ有するホウ酸エステルとLiPF6塩が反応し、電解液の安定性が低下したことがわかる。
【0124】
[比較例8]
乾燥窒素雰囲気のフラスコ中で、ホウ酸を9.8gと、メトキシエタノール(化学式HOCH2CH2OCH3、東京化成社製)を40.0gとを混合し、共沸溶媒としてトルエンを70g混合し、オイルバス設定140℃で6時間加熱して脱水縮合を行った。その後、減圧下でトルエンを除去し、77℃、0.8mmHgの条件で減圧蒸留を行い精製し、B(OCH2CH2OCH3)3の構造を有するホウ素化合物Iを得た。
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を9.00gと、ホウ素化合物Iを1.00gとを混合し、得られた混合液に、LiBF4を1.03g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、5.15Vであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0125】
[比較例9]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を9.00gと、ホウ素化合物Iを1.00g混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製したところ、LiPF6を溶解させた後、5時間後には、黒色の沈殿が析出し、均一な電解液が得られなかった。アルコキシ基を3つ有するホウ酸エステルとLiPF6塩が反応し、電解液の安定性が低下したことがわかる。
【0126】
実施例1から実施例10の結果を表1に、比較例1から比較例9の結果を表2にまとめた。また、電解質塩にLiPF6を用いた、実施例2、実施例3、実施例5、実施例6、実施例7、比較例2において、電解液の耐酸化電位を測定した際のリニアスイープボルタモグラムを図3に示し、実施例8、実施例9、実施例10、比較例2、比較例3、比較例5において、電解液の耐酸化電位を測定した際のリニアスイープボルタモグラムを図4に示した。さらに電解液にLiBF4を用いた、実施例1、実施例4、比較例1、比較例4、比較例6、比較例8において、電解液の耐酸化電位を測定した際のリニアスイープボルタモグラムを図5に示した。
【0127】
【表1】

【0128】
【表2】

【0129】
上記記載、表1及び表2からわかるように、本実施形態の電解液用添加剤を用いた実施例1〜10においては、ホウ素化合物は電解液と良好に相溶し、かつ、電解質との副反応を生じなかった。また、高いイオン伝導性を保持しつつ、6.4V以上の高い酸化電位を有していた。
これに対して、ホウ素化合物を添加してない比較例1及び2においては、酸化電位が低くなった。また、公知のホウ素化合物を用いた比較例3〜9においては、イオン導電性や酸化電位が低くなる、ホウ素化合物が電解質と副反応を起こして電解液中に白色沈殿を生成するといった問題が生じ、電解液の安定性に劣っていた。
【産業上の利用可能性】
【0130】
本発明の電解液用添加剤は、電気化学デバイスの電解液や、それを用いたリチウムイオン二次電池への産業上利用可能性を有する。
【技術分野】
【0001】
本発明は、電気化学デバイスの電解液に用いるのに好適な電解液用添加剤、及び電解液、リチウムイオン二次電池に関する。
【背景技術】
【0002】
近年の電子技術の発展や環境技術への関心の高まりに伴い、様々な電気化学デバイスが用いられている。特に、省エネルギー化への要請が多くあり、それに貢献できるものへの期待はますます高くなっている。そのような電気化学デバイスとしては、例えば、発電デバイスとして太陽電池が挙げられ、蓄電デバイスとして、二次電池、キャパシタ及びコンデンサなどが挙げられる。蓄電デバイスの代表例であるリチウムイオン二次電池は、従来、主として携帯機器用充電地として使用されていたが、近年ではハイブリッド自動車及び電気自動車用電池としての使用が期待されている。
そのような流れの中で、リチウムイオン二次電池にはより一層高いエネルギー密度が求められており、その高いエネルギー密度を達成するため、電池の高電圧化が検討されている。電池の高電圧化には正極の電位を高める必要があり、それに伴い、リチウムイオン二次電池の非水電解液に関しても、高電位における電気化学安定性、即ち耐酸化性を有し、高電圧下でも使用できる電解液が望まれている。
【0003】
上記課題に対して、特許文献1には、電解液の非水溶媒として、フッ素化されたエチレンカーボネート(EC)を用いることにより高電位における安定性の向上を図ることが提案されている。
一方、特許文献2には、ある特定のホウ酸トリアルコキシドを電解液に添加することにより高電位における安定性の向上を図ることが提案されている。また、特許文献3には、ホウ酸トリアルコキシドと非水溶媒とを混合することにより、負極界面での抵抗増大を抑制することなどが提案されている。さらに、特許文献4には、ホウ素の六員環状アルコキシド化合物を非水溶媒に添加することにより、銅−スズ系負極の容量維持率を改善することなどが提案されている。
他方、特許文献5には、トリフェニルボランを電解液に添加することが開示されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開2011−034162号パンフレット
【特許文献2】国際公開2011−037263号パンフレット
【特許文献3】特開2003−132946号公報
【特許文献4】特開2005−222830号公報
【特許文献5】特開平11−003728号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、特許文献1に開示されている非水溶媒のフッ素化は高コストであり、また電解質の溶解性が低下するという問題がある。
また、特許文献1〜4に記載されているように、ホウ酸アルコキシドを電解液に添加する試みはこれまでにも多くなされている。しかしながら、これらのホウ酸アルコキシドは、エステル交換しやすく、非水溶媒中のLiPF6塩と容易にエステル交換し、LiPF6塩を消費して電解液の保存安定性が低下するという課題を有している。
さらに、特許文献5に開示されているトリフェニルボランに代表されるトリアルキルボランは、反応活性が高く、空気中で安定に取り扱うことが難しいといった問題がある。
上述したとおり、リチウムイオン二次電池における高いエネルギー密度を達成するため、電池の高電圧化が検討されており、リチウムイオン二次電池の非水電解液においても、実用に耐え得るイオン伝導性及び長期安定性を満足し、かつ、高電位における安定性、即ち耐酸化性を有する電解液が望まれている。
【0006】
かかる事情に鑑みて、本発明は、電解液の高電位における高い安定性、即ち高い耐酸化性と、高いイオン伝導性及び長期安定性を達成することのできる電解液用添加剤及びそれを含む電解液、リチウムイオン二次電池を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは上記目的を達成すべく鋭意検討した結果、特定の構造を有するホウ素化合物を電解液用添加剤として用いることで、電解液の高電位における安定性と、高いイオン伝導性及び長期安定性を達成することができることを見出し、本発明を完成するに至った。
【0008】
即ち、本発明は下記のとおりである。
[1]
下記式(1)で表されるホウ素化合物からなる電解液用添加剤。
B(X)a(Y)b(Z)c (1)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。ただし、a=1かつb=2のとき、前記アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。)
[2]
前記式(1)で表されるホウ素化合物中のaが1又は2である、上記[1]記載の電解液用添加剤。
[3]
前記式(1)で表されるホウ素化合物中のbが1又は2である、[1]又は[2]記載の電解液用添加剤。
[4]
前記式(1)で表されるホウ素化合物が下記式(2)で表される構造を有する、上記[1]〜[3]のいずれか記載の電解液用添加剤。
B(X)a(Y)b (2)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。a,bはそれぞれ、1又は2の整数を示し、かつ、a+b=3を満たす。)
[5]
前記式(1)で表されるホウ素化合物が下記式(3)で表される構造を有する、上記[1]〜[4]のいずれか記載の電解液用添加剤。
B(X)1(Y)2 (3)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。)
[6]
上記[1]〜[5]のいずれか記載の電解液用添加剤と、非水溶媒と、電解質と、を含有する電解液。
[7]
前記電解液中の前記電解液用添加剤の含有量が、0.5質量%以上50質量%以下である、上記[6]記載の電解液。
[8]
前記電解液の酸化電位が6.3V(vsLi/Li+)以上である、上記[6]又は[7]記載の電解液。
[9]
前期非水溶媒がカーボネート系溶媒である、上記[6]〜[8]のいずれか記載の電解液。
[10]
前記電解質がリチウム塩である、上記[6]〜[9]のいずれか記載の電解液。
[11]
上記[6]〜[9]のいずれか記載の電解液と、
正極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料からなる群より選ばれる1種以上を含有する正極と、
負極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料及び金属リチウムからなる群より選ばれる1種以上を含有する負極と、
を備えるリチウムイオン二次電池。
【発明の効果】
【0009】
本発明により、電解液の高電位における安定性と、高いイオン伝導性及び長期安定性を達成することのできる電解液用添加剤、及びそれを含む電解液、リチウムイオン二次電池を提供することができる。
【図面の簡単な説明】
【0010】
【図1】比較例2における電解液の19F−NMR測定結果を示す図である。
【図2】比較例3における電解液の19F−NMR測定結果を示す図である。
【図3】実施例及び比較例の電解液の耐酸化電位測定により得られたリニアスイープボルタモグラムを示す図である。
【図4】実施例及び比較例の電解液の耐酸化電位測定により得られたリニアスイープボルタモグラムを示す図である。
【図5】実施例及び比較例の電解液の耐酸化電位測定により得られたリニアスイープボルタモグラムを示す図である。
【発明を実施するための形態】
【0011】
以下、本発明を実施するための形態(以下、単に「本実施形態」という。)について詳細に説明する。以下の本実施形態は、本発明を説明するための例示であり、本発明を以下の内容に限定する趣旨ではない。本発明は、その要旨の範囲内で適宜に変形して実施できる。
【0012】
本実施形態における電解液用添加剤は、下記式(1)で表されるホウ素化合物からなる。
B(X)a(Y)b(Z)c (1)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。ただし、a=1かつb=2のとき、前記アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。)
また、本実施形態における電解液は、上記電解液用添加剤と、非水溶媒と、電解質と、を含有する。
さらに、本実施形態におけるリチウムイオン二次電池は、上記電解液と、正極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料からなる群より選ばれる1種以上を含有する正極と、負極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料及び金属リチウムからなる群より選ばれる1種以上を含有する負極と、を備える。
【0013】
<電解液用添加剤>
本実施形態における電解液用添加剤は、下記式(1)で表されるホウ素化合物からなる。
B(X)a(Y)b(Z)c (1)
(式中、置換されていてもよいXは炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。)
【0014】
Xは置換されていてもよい炭素数3〜20の炭化水素基(以下、単に「炭化水素基」ともいう。)を示す。ここで、Xで示される炭化水素基は、ホウ素原子に直接炭素原子が結合している。ホウ素化合物中にホウ素原子に直接結合した炭化水素基が存在することにより、エステル交換、加水分解といった電解液中の副反応を抑制し、ホウ素化合物の安定性が向上するとともに、電解液の高電位における安定性が向上する。Xで示される炭化水素基は、ホウ素化合物中に1つ又は2つ含有することがより好ましい。
【0015】
本実施形態におけるXで示される炭化水素基としては、脂肪族炭化水素基のみならず、フェニル基などの芳香族炭化水素基も含まれる。また、水素原子がすべてフッ素原子に置換されたトリフルオロメチル基などのフッ素置換炭化水素基も含まれる。また、必要に応じて、フッ素原子、塩素原子、臭素原子などのハロゲン原子や、ニトリル基(−CN)、エーテル基(−O−)、カーボネート基(−OCO2−)、エステル基(−CO2−)、カルボニル基(−CO−)スルフィド基(−S−)、スルホキシド基(−SO−)、スルホン基(−SO2−)、ウレタン基(−NHCO2−)といった官能基を導入することができる。
【0016】
Xは、非水溶媒との混和性、イオン伝導性の観点から、炭素数3〜20であり、好ましくは炭素数3〜12であり、より好ましくは炭素数3〜9である。
【0017】
Xの好ましい例としては、n−プロピル基、イソプロピル基、n−ブチル基、s−ブチル基、t−ブチル基などの脂肪族炭化水素基;フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、2−メチルフェニル基、メトキシフェニル基、ニトリル置換フェニル基、フルオロ化フェニル基などの芳香族炭化水素基;ベンジル基などの脂肪族と芳香族が複合された炭化水素基が挙げられる。上記の中でも、イオン伝導性および相溶性の観点から、n−プロピル基、イソプロピル基、n−ブチル基、s−ブチル基、t−ブチル基、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、2−メチルフェニル基、フルオロ化フェニル基がより好ましい。
【0018】
本実施形態におけるホウ素化合物においては、ホウ素原子に結合する置換基が、炭化水素基、アルコキシ基又はカルボキシル基、ハロゲン原子の3種から選ばれる2種以上存在し、これらの置換基が互いに結合して環状構造をとっていても何ら差し支えない。例えば、Xで示される置換されていてもよい炭素数3〜20の炭化水素基は、ホウ素原子と共に下記式(16)で表される環状構造を形成していてもよい。なお、ホウ素化合物が下記式(16)で表される環状構造を有する場合、ホウ素化合物は、2つの炭化水素基を有することとなる。即ち、上記式(1)におけるaが2となり、b又はcが1となる。即ち、ホウ素の残り1つの結合手は、置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基、ハロゲン原子から選ばれる置換基を有することとなる。また、ホウ素化合物が下記式(16)で表される環状構造を有する場合、環状構造全体の炭素数は3〜20となる。例えば、下記式(16)において、Rは炭素数3〜20となる。環状構造の好ましい例としては、ビフェニル構造などが挙げられる。
【0019】
【化1】

【0020】
Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基(以下、単に「アルコキシ基又はカルボキシル基」ともいう。)を示す。アルコキシ基とは、下記式(4)で表される構造であり、この場合、炭素原子が酸素原子を介してホウ素原子に結合する。また、カルボキシル基とは、下記式(5)で表される構造である。本実施形態におけるホウ素化合物は、炭素数1〜20のアルコキシ基又はカルボキシル基を0〜2つの範囲で含む。アルコキシ基は、後述するカルボキシル基と同様に、ホウ素化合物中に存在することで、乾燥空気中におけるホウ素化合物の安定性が向上し、ホウ素化合物の取扱いが容易になる。炭素数1〜20のアルコキシ基又はカルボキシル基は、電解液中でのホウ素化合物の安定性が向上することから、ホウ素化合物中に合計で1つ又は2つ含有することがより好ましい。
【0021】
−OR (4)
−O(C=O)R (5)
【0022】
置換されていてもよい炭素数1〜20のアルコキシ基としては、脂肪族アルコキシ基のみならず、フェノキシ基などの芳香族アルコキシ基も含まれる。また、必要に応じて、フッ素原子、塩素原子、臭素原子などのハロゲン原子や、ニトリル基(−CN)、エーテル基(−O−)、カーボネート基(−OCO2−)、エステル基(−CO2−)、カルボニル基(−CO−)スルフィド基(−S−)、スルホキシド基(−SO−)、スルホン基(−SO2−)、ウレタン基(−NHCO2−)といった官能基を導入することができる。
【0023】
置換されていてもよい炭素数1〜20のアルコキシ基は、非水溶媒との混和性、イオン伝導性の観点から、炭素数1〜20であり、好ましくは炭素数1〜12であり、より好ましくは炭素数2〜9である。
【0024】
置換されていてもよい炭素数1〜20のアルコキシ基の好ましい例としては、メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基、n−ブトキシ基、s−ブトキシ基、t−ブトキシ基などの脂肪族炭化水素系アルコキシ基;トリフルオロエトキシ基、ヘキサフルオロイソプロポキシ基などのフルオロ化アルコキシ基;−OCH2CH2OCH3、−OCH2CH2CH2OCH3、−OCH2CH2OC2H5、−OCH2CH2CH2OC2H5などのエーテル基を含有するアルコキシ基;フェノキシ基、2,6−ジメチルフェノキシ基、2,4,6−トリメチルフェノキシ基、2−メチルフェノキシ基、フルオロ化フェノキシ基などの芳香族系アルコキシ基;−OCH2CH2CN、−OCH2CN、−OCH2CH2CH2CNなどのニトリル基を含有するアルコキシ基;ベンジルアルコキシ基などの脂肪族と芳香族が複合されたアルコキシ基が挙げられる。これらの中でも、イオン伝導性および相溶性の観点から、脂肪族炭化水素系アルコキシ基、エーテル基を含有するアルコキシ基、ニトリル基を含有するアルコキシ基がより好ましく、より高い耐酸化性を達成する観点からニトリル基を含有するアルコキシ基がさらに好ましい。
【0025】
ここで、置換されていてもよい炭素数1〜20のアルコキシ基は、ホウ素原子と共に下記式(6)で表される環状構造を形成していてもよい。この場合、上記式(1)におけるbが2となり、a又はcが1となる。即ち、ホウ素の残り1つの結合手は、置換されていてもよい炭素数3〜20の炭化水素基、ハロゲン原子から選ばれる置換基を有することとなる。また、ホウ素化合物が下記式(6)で表される環状構造を有する場合、環状構造全体の炭素数は1〜20となる。例えば、下記式(6)において、Rは炭素数1〜20となる。なお、上記式(1)のホウ素化合物の置換基のすべてが環状に結合している場合は、ホウ素化合物の全体の炭素数が1〜20となる。
【0026】
【化2】

【0027】
アルコキシ基とホウ素原子とから形成されるジアルコキシド環状構造の好ましい例としては、下記式(7)〜(10)で表される五員環構造が挙げられる。これらの五員環構造は、ホウ素化合物の分子間架橋反応などの副反応が起こりにくく、安定に存在できる傾向にある。なお、本実施形態におけるホウ素化合物には、合成時及び使用時に分子間架橋反応などを生じるおそれがあるため、アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。
【0028】
【化3】

【0029】
本実施形態におけるカルボキシル基は、上記式(5)で表される構造を有する。上述したアルコキシ基と同様、ホウ素化合物中にカルボキシル基が存在することで、乾燥空気中におけるホウ素化合物の安定性が向上し、ホウ素化合物の取扱いが容易になる。
【0030】
置換されていてもよい炭素数1〜20のカルボキシル基としては、脂肪族カルボキシル基のみならず、芳香族カルボキシル基も含まれる。また、必要に応じて、フッ素原子、塩素原子、臭素原子などのハロゲン原子や、ニトリル基(−CN)、エーテル基(−O−)、カーボネート基(−OCO2−)、エステル基(−CO2−)、カルボニル基(−CO−)スルフィド基(−S−)、スルホキシド基(−SO−)、スルホン基(−SO2−)、ウレタン基(−NHCO2−)といった官能基を導入することができる。
【0031】
置換されていてもよい炭素数1〜20のカルボキシル基は、非水溶媒との混和性、イオン伝導性の観点から、炭素数1〜20であり、好ましくは炭素数1〜12であり、より好ましくは炭素数1〜9である。ここで、カルボキシル基の炭素数は、カルボキシル構造(−O−(CO)−)を構成する炭素を含むものである。
【0032】
置換されていてよい炭素数1〜20のカルボキシル基の好ましい例としては、−OCOCH3、−OCOC2H5、−OCOC3H7、−OCOC4H9、−OCOC5H11などの脂肪族炭化水素系カルボキシル基;−OCOCF3、−OCOCH2CF3、−OCOCH(CF3)2などのフルオロ化カルボキシル基;−OCOPh、OCOCH2Phなどの芳香環を含有するカルボキシル基;後述するシュウ酸基などの環状構造を形成するカルボキシル基が挙げられる。上記の中でも、耐酸化性の観点から、−OCOCH3、−OCOC2H5、−OCOC3H7、−OCOC4H9、−OCOC5H11などの脂肪族炭化水素系カルボキシル基、後述するシュウ酸基などの環状構造を形成するカルボキシル基がより好ましい。
【0033】
ここで、置換されていてよい炭素数1〜20のカルボキシル基は、ホウ素原子と共に下記式(11)及び(12)で表される環状構造を形成していてもよい。なお、ホウ素化合物が下記式(11)又は(12)で表される環状構造を有する場合、ホウ素化合物は、2つのカルボキシル基を有することとなる。即ち、上記式(1)におけるbが2となり、a又はcが1となる。即ち、ホウ素の残り1つの結合手は、置換されていてもよい炭素数3〜20の炭化水素基、ハロゲン原子から選ばれる置換基を有することとなる。また、ホウ素化合物が環状構造を有する場合、環状構造全体の炭素数は1〜20となる。例えば、下記式(11)においては、2つのカルボキシル基が2つの炭素を有するため、Rは炭素数1〜18となる。
【0034】
ホウ素化合物が上述した環状構造を有する場合、異なった置換基がホウ素原子と共に環状構成を形成していてもよい。例えば、炭化水素基とカルボキシル基が環状構造を形成していてもよい。
【0035】
【化4】

【0036】
カルボキシル基とホウ素原子とから形成されるジカルボキシル環状構造の好ましい例としては、下記式(13)〜(15)で表される構造が挙げられる。これらの構造は、ホウ素化合物の安定性の観点から好ましい。
【0037】
【化5】

【0038】
Zはハロゲン原子を示す。ハロゲン原子は、フッ素原子、塩素原子、臭素原子、ヨウ素原子から選ばれるが、電解液中での安定性の観点から、フッ素原子、塩素原子が好ましく、フッ素原子がより好ましい。
【0039】
本実施形態における上記式(1)で表されるホウ素化合物は、上記式(1)中のXが置換されていてもよい炭素数3〜20の炭化水素基を示し、Yが置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示し、a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満足する。これは、即ち、アルコキシ基又はカルボキシル基、炭化水素基、ハロゲン原子の3種の中から選ばれる2種以上を含有させることを示しており、これにより電解液の高い高電圧安定性、長期安定性を達成するとともに、LiPF6塩に代表される電解質との副反応を抑制し、その結果、高いイオン伝導性をも達成することができる。
【0040】
なお、上記式(1)中でa=3のとき、ホウ素化合物の置換基がすべて炭化水素基であるBR3となり、b=3のとき、ホウ素化合物の置換基がすべてアルコキシ基又はカルボキシル基であるB(OR)3又はB(OCOR)3となり、c=3のとき、ホウ素化合物の置換基がすべてハロゲン原子であるボラントリハライドとなるが、これらのBR3、B(OR)3、B(OCOR)3、ボラントリハライドは本実施形態のホウ素化合物には含まれない。本実施形態における上記式(1)で表されるホウ素化合物は、アルコキシ基又はカルボキシル基、炭化水素基、ハロゲン原子の3種の中から2種以上を含有させることで、B(OR)3、B(OCOR)3よりも加水分解及びエステル交換が起こりにくく、電解液中でLiPF6塩に代表される電解質との副反応を抑制することができ、かつ、ホウ素化合物のルイス酸性が高いことから、電解液の高電位安定性をより高めることができる。また、本実施形態における上記式(1)で表されるホウ素化合物は、BR3よりも高い酸素安定性及び空気安定性を有することから、空気中での電解液の調製、保管が容易となる。さらに、本実施形態における上記式(1)で表されるホウ素化合物は、ボラントリハライドに比べて電解液中での副反応をより抑制することができる。
【0041】
本実施形態における上記式(1)で表されるホウ素化合物は、aが1又は2であることが好ましい。これは、ホウ素化合物が炭化水素基を1つ又は2つ含有することを示しており、ホウ素化合物中に1つ又は2つの炭化水素基を含有させることにより、電解液中でのLiPF6塩に代表される電解質との副反応を大幅に抑制することができる傾向にあり、かつ、ホウ素化合物のルイス酸性が高まることから、電解液の高電位安定性をより高めることができる傾向にある。
【0042】
本実施形態における上記式(1)で表されるホウ素化合物は、bが1又は2であることが好ましい。これは、ホウ素化合物がアルコキシ基又はカルボキシル基を合計で1つ又は2つ含有することを示しており、ホウ素化合物中に合計で1つ又は2つのアルコキシ基又はカルボキシル基を含有させることにより、ホウ素化合物が高い酸素安定性を有し、乾燥空気中での電解液の調製、保管が容易となる傾向にある。また、ホウ素化合物中に合計で1つ又は2つのアルコキシ基又はカルボキシル基を含有させることにより、電解液の低電位側の安定性、即ち還元安定性が向上する傾向にある。
【0043】
本実施形態における上記式(1)で表されるホウ素化合物は、下記式(2)で表される構造を有することがより好ましい。
B(X)a(Y)b (2)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。a,bはそれぞれ、1又は2の整数を示し、かつ、a+b=3を満たす。)
【0044】
上記式(2)で表される構造は、ホウ素化合物が、少なくとも炭化水素基と、アルコキシ基又はカルボキシル基とを有し、炭化水素基と、アルコキシ基又はカルボキシル基の合計が3となる。このような構造を有することにより、ホウ素化合物がより高い酸素安定性を示すとともに、電解液中でのLiPF6塩に代表される電解質との副反応を大幅に抑制することができ、かつ、ホウ素化合物のルイス酸性が高まることから、電解液の高電位安定性をより高めることができる傾向にある。
【0045】
本実施形態における上記式(1)で表されるホウ素化合物は、下記式(3)で表される構造を有することがさらに好ましい。
B(X)1(Y)2 (3)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は炭素数1〜20のカルボキシル基を示す。)
【0046】
下記式(3)で表される構造は、炭化水素基を1つと、アルコキシ基又はカルボキシル基から選ばれる置換基を2つ含有するホウ素化合物である。
【0047】
上記式(3)で表されるホウ素化合物の中でも特に好ましい構造として、下記式(17)で表される炭化水素基を1つとアルコキシ基を2つ含有するホウ素化合物、下記式(18)で表される炭化水素基を1つとカルボキシル基を2つ含有するホウ素化合物、下記式(19)で表される炭化水素基を1つとアルコキシ基を2つ含有し、2つのアルコキシ基とホウ素原子とから形成される環状構造を有するホウ素化合物、及び、下記式(20)で表されるアルキル基を1つとカルボキシル基を2つ含有し、2つのカルボキシル基とホウ素原子とから形成される環状構造を有するホウ素化合物を挙げることができる。
【0048】
【化6】

【0049】
上記式(17)で表されるホウ素化合物において、R1としては特に限定されないが、非水溶媒との相溶性及び高電位安定性の観点から、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、フルオロフェニル基、−C4H9、−C3H7であることが好ましい。また、R2及びR3としては、それぞれ独立に、−CH3、−C2H5、−C3H7、−C4H9、−C2H4CN、−C2H4OCH3、−CH2CF3、−CH(CF3)2であることが好ましい。
【0050】
上記式(18)で表されるホウ素化合物において、R1としては特に限定されないが、非水溶媒との相溶性及び高電位安定性の観点から、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、フルオロフェニル基、−C4H9、−C3H7であることが好ましい。また、R2及びR3としては、それぞれ独立に、−CH3、−C2H5、−C3H7、−C4H9、−C2H4CN、−C2H4OCH3、−CH2CF3、−CH(CF3)2であることが好ましい。
【0051】
上記式(19)で表されるホウ素化合物において、R1としては特に限定されないが、非水溶媒との相溶性及び高電位安定性の観点から、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、フルオロフェニル基、−C4H9、−C3H7であることが好ましい。また、Rとしては、−CH2CH2−、−CH(CH3)CH(CH3)−、−C(CH3)2C(CH3)2−、−CH=CH−、フェニル基であることが好ましい。
【0052】
上記式(20)で表されるホウ素化合物において、R1としては特に限定されないが、非水溶媒との相溶性及び高電位安定性の観点から、フェニル基、2,6−ジメチルフェニル基、2,4,6−トリメチルフェニル基、フルオロフェニル基、−C4H9、−C3H7であることが好ましい。Rとしては、−CH2−、−CH2CH2−、フェニル基であることが好ましい。また、Rとしては、炭素数0、即ちシュウ酸エステル構造であることも好ましい。
【0053】
本実施形態におけるホウ素化合物の合成方法は特に限定されず、例えば、以下に示すような合成手法を用いて合成することができる。Xで示される炭化水素基の導入に関しては、BH3と不飽和炭化水素基のハイドロボレーション反応、グリニャール試薬を用いた炭化水素基−MgBrとB(OCH3)3を用いたグリニャール反応、を好適に用いることができる。Yで示されるアルコキシ基の導入に関しては、BH3とアルコールの脱水素反応、H3BO3とアルコールを用いた脱水縮合、を好適に用いることができる。Yで示されるカルボキシル基の導入に関しては、H3BO3とカルボン酸を用いた脱水縮合を好適に用いることができる。Zで示されるハロゲン原子の導入に関しては、ボラントリハライドとの交換反応を好適に用いることができる。また、2つの異なるアルコキシ基を導入する方法としては、例えば、R1B(OH)2とHOR4との脱水縮合によりR1B(O−R4)2の構造を有する化合物を合成し、R1B(OH)2とHOR5との脱水縮合によりR1B(O−R5)2の構造を有する化合物を合成した後に、得られたこれらのR1B(O−R4)2の構造を有する化合物とR1B(O−R5)2の構造を有する化合物を等mol混合し、室温で攪拌してエステル交換反応をさせることにより、R1B(O−R4)(O−R5)の構造を有する化合物を得ることができる。
【0054】
<電解液>
本実施形態における電解液は、上記式(1)で表されるホウ素化合物と、非水溶媒と、電解質と、を含有する。本実施形態における電解液は、リチウムイオン二次電池、リチウムイオンキャパシタに代表される蓄電デバイスの電解液として好適に用いることができる。
【0055】
非水溶媒としては、様々なものを用いることができるが、リチウムイオン二次電池及びリチウムイオンキャパシタなどの電解液に用いられる場合、非プロトン性極性溶媒が好ましい。その具体例としては、エチレンカーボネート、プロピレンカーボネート、1,2−ブチレンカーボネート、トランス−2,3−ブチレンカーボネート、シスー2,3−ブチレンカーボネート、1,2−ペンチレンカーボネート、トランス−2,3−ペンチレンカーボネート、シスー2,3−ペンチレンカーボネート、トリフルオロメチルエチレンカーボネート、フルオロエチレンカーボネート及び4,5−ジフルオロエチレンカーボネートになどの環状カーボネート;γープチロラクトン及びγーバレロラクトンなどのラクトン;スルホランなどの環状スルホン;テトラヒドロフラン及びジオキサンなどの環状エーテル;メチルエチルカーボネート、ジメチルカーボネート、ジエチルカーボネート、メチルプロピルカーボネート、メチルイソプロビルカーボネート、ジプロピルカーボネート、メチルブチルカーボネート、ジブチルカーボネート、エチルプロピルカーボネート及びメチルトリフルオロエチルカーボネートなどの鎖状カーボネート;アセトニトリルなどのニトリル;ジメチルエーテルなどの鎖状エ一テル;プロピオン酸メチルなどの鎖状カルボン酸エステル;ジメトキシエタンなどの鎖状エーテルカーボネート化合物が挙げられる。これらは1種を単独で又は2種以上を組み合わせて用いることができる。
【0056】
非水溶媒としては、イオン伝導性の観点から、環状カーボネート、鎖状カーボネートなどのカーボネート系溶媒を用いることがより好ましい。また、カーボネート系溶媒として、環状カーボネートと鎖状カーボネートを組合せて用いることがさらに好ましい。環状カーボネートとしては様々なものを用いることができるが、エチレンカーボネート、プロピレンカーボネート、フルオロエチレンカーボネートが好ましく、エチレンカーボネート、プロピレンカーボネートがより好ましい。鎖状カーボネートとしては様々なものを用いることができるが、メチルエチルカーボネート、ジメチルカーボネート、ジエチルカーボネートが好ましい。
【0057】
カーボネート系溶媒として、環状カーボネートと鎖状カーボネートを組合せて含む場合、環状カーボネートと鎖状カーボネートとの混合比は、イオン伝導性の観点から、体積比で1:10〜5:1であることが好ましく、1:5〜3:1であることがより好ましい。
【0058】
カーボネート系溶媒を用いる場合、電池物性改善の観点から、必要に応じて、アセトニトリル、スルホラン等の別の非水溶媒をさらに添加することができる。
【0059】
特に、電解液がリチウムイオン二次電池及びリチウムイオンキャパシタに使用される場合、その充放電に寄与する電解質であるリチウム塩の電離度を高めるために、非水溶媒は、環状の非プロトン性極性溶媒を1種以上含むことが好ましい。同様の観点から、非水溶媒は、エチレンカーボネート及びプロピレンカーボネートなどの環状カーボネートを1種以上含むことがより好ましい。環状の化合物は誘電率が高く、リチウム塩の電離を助けることによりイオン伝導性の向上に寄与することができる。
【0060】
電解質は、電解液において、通常の非水電解質として用いられているものであれば特に限定されない。電解液がリチウムイオン二次電池及びリチウムイオンキャパシタに用いられる場合、電解質としてはリチウム塩を使用することが好ましい。リチウム塩としては、例えば、LiPF6、LiBF4、LiCIO4、LiAsF6、Li2SiF6、LiOSO2CkF2k+1〔kは1〜8の整数〕、LiN(SO2CkF2k+1)2〔kは1〜8の整数〕、LiPFn(CkF2k+1)6-n[nは1〜5の整数、kは1〜8の整数〕、LiBFn((CkF2k+1)4-n[nは1〜3の整数、kは1〜8の整数〕、LiB(C204)2で表されるリチウムビスオキサリルボレート、LiBF2(C204)で表されるリチウムジフルオロオキサリルボレート、LiPF4(C202)で表されるリチウムトリフルオロオキサリルフォスフエートが挙げられる。
【0061】
これらの電解質は、1種を単独で又は2種以上を組み合わせて用いることができる。リチウムイオン二次電池及びリチウムイオンキャパシタの用途では、これらの電解質の中でも、イオン伝導性や安定性の観点から、LiPF6、LiBF4、LiN(SO2CkF2k+1)2〔kは1〜8の整数〕、及びLiB(C2O4)2が好ましく、LiPF6、及びLiBF4がより好ましい。
【0062】
電解質の濃度は特に限定されないが、イオン伝導性の観点から、電解液に対して0.1〜3mol/kgであることが好ましく、より好ましくは0.3〜2.5mol/kg、さらに好ましくは、0.5〜2mol/kg、特に好ましくは0.5〜1.5mol/kgである。
【0063】
本実施形態における式(1)で表される電解液用添加剤の電解液中の含有量は特に制限されないが、好ましくは、0.5質量%以上50質量%以下である。電解液用添加剤の含有量を0.5質量%以上とすることで、電解液に良好な高電位における安定性を付与することができる傾向にあり、50質量%以下とすることで、良好なイオン伝導性を付与することができる傾向にある。より好ましくは1質量%以上40質量%以下、さらに好ましくは2質量%以上35質量%以下、特に好ましくは3質量%以上30質量%以下である。
【0064】
本実施形態における式(1)で表されるホウ素化合物は、必要に応じて1種又は2種以上混合して用いてもよい。2種以上混合して用いる場合の含有量は特に制限されないが、2種以上のホウ素化合物の含有量の合計が上記含有量の範囲を満たすことが好ましい。
【0065】
本実施形態における電解液は、酸化電位が6.3V(vsLi/Li+)以上であることが好ましい。電解液の酸化電位を6.3V(vsLi/Li+)以上とすることで高電位における高い安定性が確保され、電池に高電位の正極を用いても、電解液が大きく劣化することなく、高電位化した電池のより高い安定性に寄与できる傾向にある。電解液の酸化電位は、6.35V(vsLi/Li+)以上であることがより好ましく、6.4V(vsLi/Li+)以上であることがさらに好ましい。ここで、酸化電位の測定手法としては、作用極に白金極、対極及び参照極に金属Li極を用いた三極セルに電解液を注入して測定セルを作製し、ポテンシオガルバノスタットを用いて測定セルのリニアスイープボルタンメトリー(以下、「LSV」ともいう。)を行うことにより測定することができる。LSV測定で自然電位から7.5V(vsLi/Li+)まで0.1mV/secで掃引し、電流値が0.1mA/cm2となる電位を電解液の酸化電位とする。この酸化電位が高電位安定性の指標となる。
【0066】
本実施形態における電解液には、必要に応じて、本実施形態のホウ素化合物以外の添加剤を含有させることができる。電池のサイクル特性を向上させる観点からは、ビニレンカーボネート、フルオロエチレンカーボネート、エチレンスルファイトなどを添加剤として含有させることが好ましい。
【0067】
<リチウムイオン二次電池>
本実施形態における電解液は、リチウムイオン二次電池の電解液として好適に用いることができる。本実施形態におけるリチウムイオン二次電池は、上述した電解液と、正極、負極と、必要に応じてセパレータを備える。
【0068】
正極は、リチウムイオン二次電池の正極として作用するものであれば特に限定されず、公知のものを用いることができる。正極は、正極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料からなる群より選ばれる1種以上を含有することが好ましい。そのような材料としては、例えば、LixMO2(ここで、Mは遷移金属から選ばれる1種以上の金属を示し、Xは0〜1の数を示す。)及びLiyM2O4(ここで、Mは遷移金属から選ばれる1種以上の金属を示し、yは0〜2の数を示す。)で表される複合酸化物、トンネル構造及び層状構造を有する金属カルコゲン化物及び金属酸化物、オリビン型リン酸化合物が挙げられる。
【0069】
リチウムイオンを吸蔵及び放出することが可能な材料としては、より具体的には、例えば、LiCoO2などのリチウムコバルト酸化物;LiMnO2、LiMn2O4、Li2Mn2O4などのリチウムマンガン酸化物;LiNiO2などのリチウムニッケル酸化物;LiNi0.33Mn0.33Co0.33O2などのLizMO2(ここで、MはNi、Mn、Co、AI及びMgからなる群より選ばれる2種以上の元素を示し、zは0.9超1.2未満の数を示す。)で表されるリチウム含有複合金属酸化物;LiFePO4で表されるリン酸鉄オリビン;LiNi0.5Mn1.5O4などの高電圧対応正極;Li2M’O3−LiMO2(ここで、M’及びMは遷移金属から選ばれる1種以上の金属を示す。)などの固溶体正極が挙げられる。また、正極活物質として、例えば、S、MnO2、Fe02、FeS2、V205、V6013、TiO2、TiS2、MoS2及びNbSe2などのリチウム以外の金属の酸化物を含んでいてもよい。さらには、ポリアニリン、ポリチオフエン、ポリアセチレン及びポリピロールなどの導電性高分子も正極活物質として含んでいてもよい。
【0070】
また、正極活物質としてリチウム含有化合物を用いると、高電圧及び高エネルギー密度を得ることができる傾向にあるため好ましい。このようなリチウム含有化合物としては、リチウムを含有するものであればよく、例えば、リチウムと遷移金属元素とを含む複合酸化物、リチウムと遷移金属元素とを含むリン酸化合物、及びリチウムと遷移金属元素とを含むLitMuSiO4(ここで、Mは遷移金属から選ばれる1種以上の金属、tは0〜1の数、uは0〜2の数を示す。)などのケイ酸金属化合物が挙げられる。より高い電圧を得る観点から、特に、リチウムと、コバルト(Co)、ニッケル(Ni)、マンガン(Mn)、鉄(Fe)、(Cu)、亜鉛(Zn)、クロム(Cr)、バナジウム(V)及びチタン(Ti)からなる群より選ばれる1種以上の遷移金属元素とを含む複合酸化物やリン酸化合物が好ましい。
【0071】
リチウム含有化合物としては、リチウムを有する金属酸化物、リチウムを有する金属カルコゲン化物及びリチウムを有するリン酸金属化合物が好ましく、例えば、下記式(21a)及び(21b)で表される化合物が挙げられる。
LiMO2 (21a)
LiMPO4 (21b)
ここで、式中、Mは1種以上の遷移金属元素を示す。
【0072】
上記式(21a)で表される化合物は一般に層状構造を有し、上記一般式(21b)で表される化合物は一般にオリビン構造を有する。これらの化合物は、構造を安定化させる等の目的から、遷移金属元素の一部をAI、Mg、その他の遷移金属元素で置換したり結晶粒界に含ませたりしたもの、酸素原子の一部をフッ素原子等で置換したものであってもよい。更に、正極活物質表面の少なくとも一部に他の正極活物質を被覆したものも挙げられる。
【0073】
正極活物質は、1種を単独で又は2種以上を組み合わせて用いることができる。正極活物質の数平均粒子径(一次粒子径)は、好ましくは0.05μm〜100μm、より好ましくは1μm〜10μmである。正極活物質の数平均粒子径は、湿式の粒子径測定装置(例えば、レーザー回折/散乱式粒度分布計、動的光散乱式粒度分布計)により測定することができる。あるいは、透過型電子顕微鏡にて観察した粒子100個をランダムに抽出し、画像解析ソフト(例えば、旭化成エンジニアリング株式会社製の画像解析ソフト、商品名「A像くん」)で解析し、その相加平均を算出することでも得られる。この場合、同じ試料に対して、測定方法間で数平均粒子径が異なる場合は、標準試料を対象として作成した検量線を用いてもよい。
【0074】
正極は、例えば、下記のようにして得られる。まず、上記正極活物質に対して、必要に応じて、導電助剤やバインダー等を加えて混合した正極合剤を溶剤に分散させて正極合剤含有ペーストを調製する。次いで、この正極合剤含有ペーストを正極集電体に塗布し、乾燥して正極合剤層を形成し、それを必要に応じて加圧し厚みを調整することによって、正極が作製される。ここで、正極合剤含有ペースト中の固形分濃度は、好ましくは30〜80質量%であり、より好ましくは40〜70質量%である。正極集電体は、例えば、アルミニウム箔、又はステンレス箔などの金属箔により構成される。
【0075】
負極は、リチウムイオン二次電池の負極として作用するものであれば特に限定されず、公知のものを用いることができる。負極は、負極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料及び金属リチウムからなる群より選ばれる1種以上を含有することが好ましい。即ち、負極は、負極活物質として、金属リチウム、炭素材料、リチウムと合金形成が可能な元素を含む材料、及び、リチウム含有化合物からなる群より選ばれる1種以上の材料を含有することが好ましい。炭素材料としては、例えば、ハードカーボン、ソフトカーボン、人造黒鉛、天然黒鉛、黒鉛、熱分解炭素、コークス、ガラス状炭素、有機高分子化合物の焼成体、メソカーボンマイクロビーズ、炭素繊維、活性炭、グラファイト、炭素コロイド、カーボンブラックが挙げられる。コークスとしては、例えば、ピッチコークス、二一ドルコークス及び石油コークスが挙げられる。また、有機高分子化合物の焼成体とは、フェノール樹脂やフラン樹脂などの高分子材料を適当な温度で焼成して炭素化したものである。
【0076】
さらに、リチウムイオンを吸蔵及び放出することが可能な材料としては、リチウムと合金を形成可能な元素を含む材料も挙げられる。この材料は金属又は半金属の単体であっても、合金や化合物であってもよく、またこれらの1種又は2種以上の相を少なくとも一部に有するようなものであってもよい。なお、本明細書において、「合金」には、2種以上の金属元素からなるものに加えて、1種以上の金属元素と1種以上の半金属元素とを有するものも含まれる。また、合金には、全体として金属の性質を有するものであれば非金属元素が含まれていてもよい。
【0077】
金属元素及び半金属元素としては、例えば、チタン(Ti)、スズ(Sn)、鉛(Pb)、アルミニウム、インジウム(In)、ケイ素(Si)、亜鉛(Zn)、アンチモン(Sb)、ビスマス(Bi)、ガリウム(Ga)、ゲルマニウム(Ge)、ヒ素(As)、銀(Ag)、ハフニウム(Hf)、ジルコニウム(Zr)及びイットリウム(Y)が挙げられる。
【0078】
これらの中でも、長周期型周期表における4族又は14族の金属元素及び半金属元素が好ましく、特に好ましくはチタン、ケイ素及びスズである。
【0079】
スズの合金としては、例えば、スズ以外の第2の構成元素として、ケイ素、マグネシウム(Mg)、ニッケル、銅、鉄、コバルト、マンガン、亜鉛、インジウム、銀、チタン(Ti)、ゲルマニウム、ビスマス、アンチモン及びクロム(Cr)からなる群より選ばれる1種以上の元素を有するものが挙げられる。
【0080】
ケイ素の合金としては、例えば、ケイ素以外の第2の構成元素として、スズ、マグネシウム、ニッケル、銅、鉄、コバルト、マンガン、亜鉛、インジウム、銀、チタン、ゲルマニウム、ビスマス、アンチモン及びクロムからなる群より選ばれる1種以上の元素を有するものが挙げられる。
【0081】
チタン化合物、スズ化合物及びケイ素化合物としては、例えば、酸素(O)又は炭素(C)を有するものが挙げられ、チタン、スズ又はケイ素に加えて、上述の第2の構成元素を有していてもよい。
【0082】
また、リチウムイオンを吸蔵及び放出することが可能な材料としては、リチウム含有化合物も挙げられる。リチウム含有化合物としては、正極材料として例示したものと同様のものが挙げられる。
【0083】
負極活物質は1種を単独で又は2種以上を組み合わせて用いることができる。負極活物質の数平均粒子径(一次粒子径)は、好ましくは0.1μm〜100μm、より好ましくは1μm〜10μmである。負極活物質の数平均粒子径は、正極活物質の数平均粒子径と同様にして測定される。
【0084】
負極は、例えば、下記のようにして得られる。即ち、まず、上記負極活物質に対して、必要に応じて、導電助剤やバインダー等を加えて混合した負極合剤を溶剤に分散させて負極合剤含有ペーストを調製する。次いで、この負極合剤含有ペーストを負極集電体に塗布し、乾燥して負極合剤層を形成し、それを必要に応じて加圧し厚みを調整することによって、負極が作製される。ここで、負極合剤含有ペースト中の固形分濃度は、好ましくは30〜80質量%であり、より好ましくは40〜70質量%である。負極集電体は、例えば、銅箔、ニッケル箔又はステンレス箔などの金属箔により構成される。
【0085】
正極及び負極の作製において、必要に応じて用いられる導電助剤としては、例えば、グラファイト、アセチレンブラック及びケッチェンブラックなどのカーボンブラックや、炭素繊維が挙げられる。導電助剤の数平均粒子径(一次粒子径)は、好ましくは0.1μm〜100μm、より好ましくは1μm〜10μmであり、正極活物質の数平均粒子径と同様にして測定される。また、バインダーとしては、例えば、ポリフッ化ビニリデン(PVDF)、ポリテトラフルオロエチレン(PTFE)、ポリアクリル酸、スチレンブタジエンゴム及びフッ素ゴムが挙げられる。
【0086】
本実施形態におけるリチウムイオン二次電池は、正負極の短絡防止、シャットダウン等の安全性付与の観点から、正極と負極との間にセパレータを備えることが好ましい。セパレータとしては、公知のリチウムイオン二次電池に備えられるものと同様のものを用いることができ、中でも、イオン透過性が大きく、機械的強度に優れる絶縁性の薄膜が好ましい。セパレータとしては、例えば、織布、不織布、合成樹脂製微多孔膜が挙げられ、これらの中でも、合成樹脂製微多孔膜が好ましい。合成樹脂製微多孔膜としては、例えば、ポリエチレン又はポリプロピレンを主成分として含有する微多孔膜、又はこれらのポリオレフィンを共に含有する微多孔膜等のポリオレフィン系微多孔膜が好適に用いられる。不織布としては、セラミック製、ポリオレフィン製、ポリエステル製、ポリアミド製、液晶ポリエステル製、アラミド製などの耐熱樹脂製の多孔膜が用いられる。セパレータは、1種の微多孔膜を単層又は複数積層したものであってもよく、2種以上の微多孔膜を積層したものであってもよい。
【0087】
本実施形態におけるリチウムイオン二次電池は、例えば、セパレータと、そのセパレータを両側から挟む正極と負極と、さらにそれらの積層体を挟む正極集電体(正極の外側に配置)と、負極集電体(負極の外側に配置)と、それらを収容する電池外装とを備える。正極とセパレータと負極とを積層した積層体は、本実施形態における電解液に含浸されている。これらの各部材としては、電解液を除いて、従来のリチウムイオン二次電池に備えられるものと同様のものを用いることができ、例えば上述したものを用いることができる。
【0088】
本実施形態におけるリチウムイオン二次電池は、上述の電解液、正極、負極及び必要に応じてセパレータを用いて、公知の方法により作製することができる。例えば、正極と負極とを、その間にセパレータを介在させた積層状態で巻回して巻回構造の積層体に成形したり、それらを折り曲げや複数層の積層などによって、交互に積層した複数の正極と負極との間にセパレータが介在する積層体に成形し、次いで、電池ケース(外装)内にその積層体を収容して、電解液をケース内部に注液し、上記積層体を電解液に浸漬して封印することによって、リチウムイオン二次電池を作製することができる。本実施形態におけるリチウムイオン二次電池の形状は、特に限定されず、例えば、円筒形、楕円形、角筒型、ボタン形、コイン形、扁平形及びラミネート形などが好適に採用される。
【0089】
本実施形態における電解液は、高電位における高い安定性、即ち高い耐酸化性と、高いイオン伝導性及び長期安定性を実現する。また、本実施形態におけるリチウムイオン二次電池は、高電位での充放電において高い安定性及び高い出力性能を有する。具体的には、電解液に上記式(1)で表される特定のホウ素化合物を含有させることにより、高いイオン伝導性を保持しつつ、高電位における安定性を大幅に向上させることができる。また、上記式(1)で表される特定のホウ素化合物を用いた場合、電解液の安定性を損なうような副反応も回避することができ電解液の長期安定性を担保することができる。さらに、リチウムイオン二次電池に上記式(1)で表される特定のホウ素化合物を含有させた電解液を用いることで、高い出力性能を保持しつつ、高電位での充放電において高い安定性を達成することができる。
【実施例】
【0090】
以下、実施例によって本発明を更に詳細に説明するが、本発明はこれらの実施例に限定されるものではない。なお、電解液用添加剤、電解液及びリチウムイオン二次電池の各種特性及び安全性は下記のとおりに測定及び評価した。
【0091】
(1)電解液のイオン伝導度測定
サンプル瓶で各成分を混合して電解液を調製した。東亜DKK(株)製の電気伝導度計「CM−21P」(商品名)に繋いだ東亜DKK(株)製の電気伝導度測定用セル「CT−57101B」(商品名)を電解液の入ったサンプル瓶に挿入し、25℃での電解液のイオン伝導度を測定した。
【0092】
(2)電解液の酸化電位測定
作用極に白金極、対極及び参照極に金属Li極を用いた三極セル(作用極及び対極の有効面積は2cm2)にポリオレフィン製セパレータを投入し、電解液を1mL注入し測定セルを作製した。ソーラトロン社製の電気化学測定装置(商品名1255B)に測定セルを接続し、自然電位から7.5V(vsLi/Li+)まで高電位側へ0.1mV/secの掃引速度でリニアスイープボルタンメトリー測定を行った。高電位側への掃引において電解液の電流値が0.1mA/cm2となる電位を電解液の酸化電位とした。
【0093】
(3)電解液中での副反応の有無の確認
各成分を混合して電解液を調製後、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液の1H−NMR、19F−NMRを測定し、電解液中で混合した各成分の副反応の有無を確認した。
【0094】
(4)電解液の保存安定性評価
各成分を混合して電解液を調製後、乾燥アルゴン雰囲気下、25℃で20日静置した電解液の変色の有無、沈殿の有無を目視で確認した。
【0095】
(5)リチウムイオン二次電池の放電容量測定
正極活物質としてLiNi0.33Mn0.33Co0.33O2(日本化学工業社製、セルシードNMC)と、導電助剤としてグラファイトとアセチレンブラックの混合粉末と、バインダーとしてポリフッ化ビニリデン溶液(クレハ社製、L#1320)とを固形分比で100:6:4.6の質量比で混合した。得られた混合物に分散溶媒としてN−メチル−2−ピロリドンを固形分66質量%となるように投入して更に混合して、スラリー状の溶液を調製した。このスラリー状の溶液を厚さ20μmのアルミニウム箔の片面に塗布し、溶剤を乾燥除去した後、ロールプレスで圧延した。圧延後のものを直径16mmの円盤状に打ち抜いて正極を得た。
負極活物質としてグラファイト粉末(大阪ガスケミカル社製、OMAC1.2H/SS)及びグラファイト粉末(TIMCAL社製、SFG6)、バインダーとしてスチレンブタジエンゴム(SBR)及びカルボキシメチルセルロース水溶液を用い、上記の順に90:10:1.5:1.8の固形分質量比で混合し、分散媒に水を用いて固形分濃度45質量%となるスラリー状の溶液を調製した。このスラリー状の溶液を厚さ18μmの銅箔の片面に塗布し、溶剤を乾燥除去した後、ロールプレスで圧延した。圧延後のものを直径16mmの円盤状に打ち抜いて負極を得た。
上述のようにして作製した正極と負極とをポリエチレンからなるセパレータ(膜厚25μm、空孔率50%、孔径0.1μm〜1μm)の両側に重ね合わせた積層体を、SUS製の円盤型電池ケースに挿入した。次いで、その電池ケース内に実施例及び比較例で作製した電解液を0.5mL注入し、積層体を電解液に浸漬した後、電池ケースを密閉してリチウムイオン二次電池を作製した。
得られたリチウムイオン二次電池の放電容量測定は、アスカ電子(株)製、充放電装置ACD−01(商品名)及び二葉科学社製、恒温槽PLM−73S(商品名)を用いて行った。1mAの定電流で充電し、4.2Vに到達した後、4.2Vの定電圧で、合計8時間充電を行った。その後、1mAの定電流で3.0Vまで放電したときの放電容量を測定した。このときの電池周囲温度は25℃に設定した。
【0096】
(6)リチウムイオン二次電池のサイクル試験後の放電容量測定
容量維持率の測定は、アスカ電子(株)製、充放電装置ACD−01(商品名)及び二葉科学社製、恒温槽PLM−73S(商品名)を用いて行った。測定用のリチウムイオン二次電池として、上記(5)リチウムイオン二次電池の放電容量測定で作製し、放電容量の測定を行った電池を用いた。充放電サイクル試験では、まず、3mAの定電流で充電し、4.2Vに到達した後、4.2Vの定電圧で、合計3時間充電を行った。その後、3mAの定電流で放電し、3.0Vに到達した時点で再び、充電を繰り返した。充電と放電とを各々1回ずつ行うのを1サイクルとし、10サイクルの充放電を行い、10サイクル目の放電容量を測定した。電池の周囲温度は25℃に設定した。
【0097】
[実施例1]
乾燥窒素雰囲気のフラスコ中で、n−ブチルボロン酸(化学式:CH3CH2CH2CH2B(OH)2、和光純薬製)を10.0gと、エチレンシアノヒドリン(化学式:HOCH2CH2CN、東京化成社製)を17.4gとを混合し、共沸溶媒としてトルエンを30g混合し、オイルバス設定140℃で6時間加熱し脱水縮合を行った。その後、減圧下でトルエンを除去後、120℃、0.5mmHgにて減圧蒸留にて精製を行い、下記式(22)で表されるホウ素化合物Aを得た。ホウ素化合物Aの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物A]1H-NMR(CDCl3) 0.81 (2H,m), 0.90 (3H,m), 1.35 (4H,m), 2.63 (4H,t,J=6.3Hz), 4.07 (4H,t,6.3Hz) pp
CH3CH2CH2CH2−B(OCH2CH2CN)2 (22)
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒(キシダ化学(株)製、LBG−00883)6.67gと、ホウ素化合物A3.33gとを混合し、得られた混合液に、LiBF4(キシダ化学(株)製)1.03gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.50Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0098】
[実施例2]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、実施例1で合成したホウ素化合物Aを3.33gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)1.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.72Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0099】
[実施例3]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を9.00gと、実施例1で合成したホウ素化合物Aを1.00gとを混合し、得られた混合液に、LiPF61.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.55Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
得られた電解液を用いてリチウムイオン二次電池を作製し、リチウムイオン二次電池の放電容量測定を行ったところ、放電容量は3.1mAhであった。また、リチウムイオン二次電池の容量維持率測定(サイクル試験)を行ったところ、10サイクル目の放電容量は、2.6mAhであった。
【0100】
[実施例4]
乾燥窒素雰囲気のフラスコ中で、2,4,6−トリメチルフェニルボロン酸(和光純薬製)を20.0gと、エチレンシアノヒドリンを22.3gとを混合し、共沸溶媒としてトルエンを40g混合し、オイルバス設定140℃で6時間加熱し脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、下記式(23)で表されるホウ素化合物Bを合成した。ホウ素化合物Bの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物B]1H-NMR(CDCl3) 2.27 (3H,s), 2.30 (6H,s), 2.64 (4H,t,J=6.3Hz), 4.08 (4H,t,J=6.3Hz),6.83 (2H,s) ppm
【0101】
【化7】

【0102】
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒6.67gと、上記式(23)で表されるホウ素化合物Bを3.33gとを混合し、得られた混合液に、LiBF4を1.03g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.46Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、1.1mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0103】
[実施例5]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒6.67gと、実施例4で合成したホウ素化合物Bを3.33gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)1.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.73Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、2.5mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0104】
[実施例6]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒9.00gと、実施例4で合成したホウ素化合物Bを1.00gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)1.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.51Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、6.8mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
得られた電解液を用いてリチウムイオン二次電池を作製し、リチウムイオン二次電池の放電容量測定を行ったところ、放電容量は3.3mAhであった。また、リチウムイオン二次電池の容量維持率測定(サイクル試験)を行ったところ、10サイクル目の放電容量は、3.0mAhであった。
【0105】
[実施例7]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒9.50gと、実施例4で合成したホウ素化合物Bを0.50gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)1.79gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.45Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、8.0mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0106】
[実施例8]
乾燥窒素雰囲気のフラスコ中で、フェニルボロン酸(化学式:Ph−B(OH)2、和光純薬製)を25.0gと、エチレンシアノヒドリンを36.3gとを混合し、共沸溶媒としてトルエンを40g混合し、オイルバス設定140℃で6時間加熱し脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、下記式(24)で表されるホウ素化合物Cを合成した。ホウ素化合物Cの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物C]1H-NMR(CDCl3) 2.70 (4H,t,J=6.1Hz), 4.31 (4H,t,J=6.1Hz), 7.78-7.79 (5H,m) ppm
【0107】
【化8】

【0108】
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒8.00gと、ホウ素化合物C2.00gとを混合し、得られた混合液に、LiPF6(キシダ化学(株)製)を1.79g添加して溶解させることによいり電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.64Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0109】
[実施例9]
乾燥窒素雰囲気のフラスコ中で、2,3,4,5,6−ペンタフルオロフェニルボロン酸(アルドリッチ社製)を10.0gと、エチレンシアノヒドリンを6.7gとを混合し、共沸溶媒としてトルエンを40g混合し、オイルバス設定140℃で6時間加熱して脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、下記式(25)で表されるホウ素化合物Dを合成した。ホウ素化合物Dの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物D]1H-NMR(CDCl3) 2.65 (4H,t,J=6.1Hz), 4.17 (4H,t,J=6.1Hz) ppm
【0110】
【化9】

【0111】
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒8.00gと、ホウ素化合物Dを2.00gとを混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.42Vと高い酸化電位を示した。また、イオン伝導度を測定したところ、3.1mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0112】
[実施例10]
乾燥窒素雰囲気のフラスコ中で、2,4,6−トリフルオロフェニルボロン酸(アルドリッチ社製)を5.0gと、エチレンシアノヒドリンを4.1gとを混合し、共沸溶媒としてトルエンを30g混合し、オイルバス設定140℃で6時間加熱して脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、下記式(26)で表されるホウ素化合物Eを合成した。ホウ素化合物Eの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物E]1H-NMR(CDCl3) 2.68 (4H,t,J=6.1Hz), 4.18 (4H,t,J=6.1Hz), 6.65 (2H,s) ppm
【0113】
【化10】

【0114】
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒9.00gと、ホウ素化合物E1.00gとを混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.52Vと高い酸化電位を示した。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0115】
[比較例1]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒10.00gに、LiBF4を1.03g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.22Vであった。また、イオン伝導度を測定したところ、3.7mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0116】
[比較例2]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒10.00gに、LiPF6(キシダ化学(株)製)を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.29Vであった。また、イオン伝導度を測定したところ、9.4mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
得られた電解液を用いてリチウムイオン二次電池を作製し、リチウムイオン二次電池の放電容量測定を行ったところ、放電容量は3.3mAhであった。また、リチウムイオン二次電池の容量維持率測定(サイクル試験)を行ったところ、10サイクル目の放電容量は、3.1mAhであった。
【0117】
[比較例3]
乾燥窒素雰囲気のフラスコ中で、ホウ酸(和光純薬製)を6.2gと、エチレンシアノヒドリンを25.0gとを混合し、共沸溶媒としてトルエンを35g混合し、オイルバス設定140℃で6時間加熱して脱水縮合を行った。その後、減圧下、140℃で減圧乾燥することにより残存トルエン及び残存エチレンシアノヒドリンを除去し、B(OCH2CH2CN)3の構造を有するホウ素化合物Fを合成した。ホウ素化合物Fの構造を1H−NMR(CDCl3)により確認した。その結果は以下の通りであった。
[化合物F]1H-NMR(CDCl3) 2.64 (6H,t,J=6.3Hz), 4.07 (6H,t,J=6.3Hz) ppm
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、合成したホウ素化合物Fを3.33g混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.62Vであった。また、イオン伝導度を測定したところ、2.8mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した後、該電解液のF−NMR測定を行ったところ、LiPF6の含有量が低減し、副反応により生成したと考えられるピークが多数生成していることがわかった。該電解液の19F−NMRを図2に、比較例2で得られた電解液の19F−NMRを図1に示す。図1のF−NMRにおいて、LiPF6に由来するピークが−73ppm及び−75ppmに確認される。これに対し、図2のF−NMRにおいては、−80ppmから−90ppm、及び−130ppmから−160ppmに、LiPF6との副反応により生成したと考えられるピークが多数生成していることがわかる。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、褐色に変色していることが確認された。アルコキシ基を3つ有するホウ酸エステルとLiPF6塩が反応し、電解液の安定性が低下したことがわかる。
【0118】
[比較例4]
乾燥窒素雰囲気のフラスコ中で、比較例3で合成したホウ素化合物Fを15.0gと、B(Oi−Pr)3(東京化成社製)を6.4g混合し、40℃で6時間加熱することで、B(Oi−Pr)(OCH2H2CN)2の構造を有するホウ素化合物Gを合成した。
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、ホウ素化合物Gを3.33gとを混合し、得られた混合液に、LiBF41.03gを添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.14Vであった。また、イオン伝導度を測定したところ、1.6mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0119】
[比較例5]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、比較例4で合成したホウ素化合物Gを3.33gとを混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、6.60Vであった。また、イオン伝導度を測定したところ、2.8mS/cmであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置したところ、電解液が褐色に変色していた。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、褐色に変色し、沈殿が生じていることが確認された。アルコキシ基を3つ有するホウ酸エステルとLiPF6塩が反応し、電解液の安定性が低下したことがわかる。
得られた電解液を用いてリチウムイオン二次電池を作製し、リチウムイオン二次電池の放電容量測定を行ったところ、放電容量は1.7mAhであった。また、リチウムイオン二次電池の容量維持率測定(サイクル試験)を行ったところ、10サイクル目の放電容量は、0.6mAhであった。
【0120】
[比較例6]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、下記式(27)で表されるメトキシピナコールボラン(アルドリッチ社製、以下、「ホウ素化合物H」という。)を3.33gとを混合し、得られた混合液に、LiBF4(キシダ化学(株)製)を1.03g添加して溶解させることにより電解液を作製した。
【0121】
【化11】

【0122】
得られた電解液の酸化電位測定を行ったところ、5.51Vであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0123】
[比較例7]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を6.67gと、ホウ素化合物Hを3.33gとを混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製したところ、LiPF6を溶解させた後、30分後には白色の沈殿が析出し、均一な電解液が得られなかった。アルコキシ基を3つ有するホウ酸エステルとLiPF6塩が反応し、電解液の安定性が低下したことがわかる。
【0124】
[比較例8]
乾燥窒素雰囲気のフラスコ中で、ホウ酸を9.8gと、メトキシエタノール(化学式HOCH2CH2OCH3、東京化成社製)を40.0gとを混合し、共沸溶媒としてトルエンを70g混合し、オイルバス設定140℃で6時間加熱して脱水縮合を行った。その後、減圧下でトルエンを除去し、77℃、0.8mmHgの条件で減圧蒸留を行い精製し、B(OCH2CH2OCH3)3の構造を有するホウ素化合物Iを得た。
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を9.00gと、ホウ素化合物Iを1.00gとを混合し、得られた混合液に、LiBF4を1.03g添加して溶解させることにより電解液を作製した。
得られた電解液の酸化電位測定を行ったところ、5.15Vであった。また、乾燥アルゴン雰囲気下、25℃で24時間静置した電解液のNMR測定を行ったところ、副反応を示すピークは見られなかった。更に、乾燥アルゴン雰囲気下、25℃で20日静置した電解液を目視で観察したところ、変色、沈殿といった溶液の変化は見られなかった。
【0125】
[比較例9]
乾燥アルゴン雰囲気下、エチレンカーボネートとエチルメチルカーボネートとを体積比1:2で混合した混合溶媒を9.00gと、ホウ素化合物Iを1.00g混合し、得られた混合液に、LiPF6を1.79g添加して溶解させることにより電解液を作製したところ、LiPF6を溶解させた後、5時間後には、黒色の沈殿が析出し、均一な電解液が得られなかった。アルコキシ基を3つ有するホウ酸エステルとLiPF6塩が反応し、電解液の安定性が低下したことがわかる。
【0126】
実施例1から実施例10の結果を表1に、比較例1から比較例9の結果を表2にまとめた。また、電解質塩にLiPF6を用いた、実施例2、実施例3、実施例5、実施例6、実施例7、比較例2において、電解液の耐酸化電位を測定した際のリニアスイープボルタモグラムを図3に示し、実施例8、実施例9、実施例10、比較例2、比較例3、比較例5において、電解液の耐酸化電位を測定した際のリニアスイープボルタモグラムを図4に示した。さらに電解液にLiBF4を用いた、実施例1、実施例4、比較例1、比較例4、比較例6、比較例8において、電解液の耐酸化電位を測定した際のリニアスイープボルタモグラムを図5に示した。
【0127】
【表1】

【0128】
【表2】

【0129】
上記記載、表1及び表2からわかるように、本実施形態の電解液用添加剤を用いた実施例1〜10においては、ホウ素化合物は電解液と良好に相溶し、かつ、電解質との副反応を生じなかった。また、高いイオン伝導性を保持しつつ、6.4V以上の高い酸化電位を有していた。
これに対して、ホウ素化合物を添加してない比較例1及び2においては、酸化電位が低くなった。また、公知のホウ素化合物を用いた比較例3〜9においては、イオン導電性や酸化電位が低くなる、ホウ素化合物が電解質と副反応を起こして電解液中に白色沈殿を生成するといった問題が生じ、電解液の安定性に劣っていた。
【産業上の利用可能性】
【0130】
本発明の電解液用添加剤は、電気化学デバイスの電解液や、それを用いたリチウムイオン二次電池への産業上利用可能性を有する。
【特許請求の範囲】
【請求項1】
下記式(1)で表されるホウ素化合物からなる電解液用添加剤。
B(X)a(Y)b(Z)c (1)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。ただし、a=1かつb=2のとき、前記アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。)
【請求項2】
前記式(1)で表されるホウ素化合物中のaが1又は2である、請求項1記載の電解液用添加剤。
【請求項3】
前記式(1)で表されるホウ素化合物中のbが1又は2である、請求項1又は2記載の電解液用添加剤。
【請求項4】
前記式(1)で表されるホウ素化合物が下記式(2)で表される構造を有する、請求項1〜3のいずれか1項記載の電解液用添加剤。
B(X)a(Y)b (2)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。a,bはそれぞれ、1又は2の整数を示し、かつ、a+b=3を満たす。)
【請求項5】
前記式(1)で表されるホウ素化合物が下記式(3)で表される構造を有する、請求項1〜4のいずれか1項記載の電解液用添加剤。
B(X)1(Y)2 (3)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。)
【請求項6】
請求項1〜5のいずれか1項記載の電解液用添加剤と、非水溶媒と、電解質と、を含有する電解液。
【請求項7】
前記電解液中の前記電解液用添加剤の含有量が、0.5質量%以上50質量%以下である、請求項6記載の電解液。
【請求項8】
前記電解液の酸化電位が6.3V(vsLi/Li+)以上である、請求項6又は7記載の電解液。
【請求項9】
前期非水溶媒がカーボネート系溶媒である、請求項6〜8のいずれか1項記載の電解液。
【請求項10】
前記電解質がリチウム塩である、請求項6〜9のいずれか1項記載の電解液。
【請求項11】
請求項6〜9のいずれか1項記載の電解液と、
正極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料からなる群より選ばれる1種以上を含有する正極と、
負極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料及び金属リチウムからなる群より選ばれる1種以上を含有する負極と、
を備えるリチウムイオン二次電池。
【請求項1】
下記式(1)で表されるホウ素化合物からなる電解液用添加剤。
B(X)a(Y)b(Z)c (1)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示し、Zはハロゲン原子を示す。a,b,cはそれぞれ、0〜2の整数を示し、かつ、a+b+c=3を満たす。ただし、a=1かつb=2のとき、前記アルコキシ基とホウ素原子とから形成されるジアルコキシド六員環構造を有する化合物は含まれない。)
【請求項2】
前記式(1)で表されるホウ素化合物中のaが1又は2である、請求項1記載の電解液用添加剤。
【請求項3】
前記式(1)で表されるホウ素化合物中のbが1又は2である、請求項1又は2記載の電解液用添加剤。
【請求項4】
前記式(1)で表されるホウ素化合物が下記式(2)で表される構造を有する、請求項1〜3のいずれか1項記載の電解液用添加剤。
B(X)a(Y)b (2)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。a,bはそれぞれ、1又は2の整数を示し、かつ、a+b=3を満たす。)
【請求項5】
前記式(1)で表されるホウ素化合物が下記式(3)で表される構造を有する、請求項1〜4のいずれか1項記載の電解液用添加剤。
B(X)1(Y)2 (3)
(式中、Xは置換されていてもよい炭素数3〜20の炭化水素基を示し、Yは置換されていてもよい炭素数1〜20のアルコキシ基又は置換されていてもよい炭素数1〜20のカルボキシル基を示す。)
【請求項6】
請求項1〜5のいずれか1項記載の電解液用添加剤と、非水溶媒と、電解質と、を含有する電解液。
【請求項7】
前記電解液中の前記電解液用添加剤の含有量が、0.5質量%以上50質量%以下である、請求項6記載の電解液。
【請求項8】
前記電解液の酸化電位が6.3V(vsLi/Li+)以上である、請求項6又は7記載の電解液。
【請求項9】
前期非水溶媒がカーボネート系溶媒である、請求項6〜8のいずれか1項記載の電解液。
【請求項10】
前記電解質がリチウム塩である、請求項6〜9のいずれか1項記載の電解液。
【請求項11】
請求項6〜9のいずれか1項記載の電解液と、
正極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料からなる群より選ばれる1種以上を含有する正極と、
負極活物質としてリチウムイオンを吸蔵及び放出することが可能な材料及び金属リチウムからなる群より選ばれる1種以上を含有する負極と、
を備えるリチウムイオン二次電池。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−98057(P2013−98057A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−240618(P2011−240618)
【出願日】平成23年11月1日(2011.11.1)
【出願人】(000000033)旭化成株式会社 (901)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年11月1日(2011.11.1)
【出願人】(000000033)旭化成株式会社 (901)
【Fターム(参考)】
[ Back to top ]

